
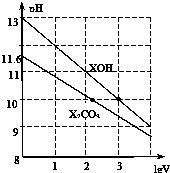
 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是强碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1×10-10•2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
分析 A.根据图知,0.1mol/L的XOH的pH=13,说明XOH溶液中c(OH-)=c(XOH);
B.XOH是强碱溶液、X2CO3是强碱弱酸盐溶液,要使两种溶液的pH相等,则c(XOH)<c(X2CO3),再结合物料守恒判断;
C.0.10mol/LX2CO3溶液的pH=11.6,则该溶液中c(OH-)=c(HCO3-)=$\frac{1{0}^{-14}}{1{0}^{-11.6}}$mol/L=10-2.4 mol/L,c(CO32-)=0.1mol/L,Kh1=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=,则Ka2=$\frac{{K}_{w}}{{K}_{h1}}$=$\frac{Kwc(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}$;
D.当lgV=2时,则溶液的体积变为原来的100倍,升高温度,促进水解,第一步水解程度远远大于第二步,所以溶液中c(CO32-)减小,c(HCO3-)增大.
解答 解:A.根据图知,0.1mol/L的XOH的pH=13,说明XOH溶液中c(OH-)=c(XOH),XOH完全电离,为强电解质,即为强碱,故A正确;
B.XOH是强碱溶液、X2CO3是强碱弱酸盐溶液,要使两种溶液的pH相等,则c(XOH)<c(X2CO3),再结合物料守恒得c(X+):XOH小于X2CO3,故B错误;
C.0.10mol/LX2CO3溶液的pH=11.6,则该溶液中c(OH-)=c(HCO3-)=$\frac{1{0}^{-14}}{1{0}^{-11.6}}$mol/L=10-2.4 mol/L,c(CO32-)=0.1mol/L,Kh1=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=,则Ka2=$\frac{{K}_{w}}{{K}_{h1}}$=$\frac{Kwc(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}$=$\frac{1{0}^{-14}×0.1}{1{0}^{-2.4}×1{0}^{-2.4}}$=1.0×10-10.2,故C正确;
D.当lgV=2时,则溶液的体积变为原来的100倍,升高温度,促进水解,第一步水解程度远远大于第二步,所以溶液中c(CO32-)减小,c(HCO3-)增大,所以$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$增大,故D错误;
故选AC.
点评 本题考查离子浓度大小比较,侧重考查学生分析判断及计算能力,为高频考点,明确电离平衡常数与水解平衡常数的关系是解本题关键,注意:二元弱酸中存在Kh1.Ka2=Kw,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
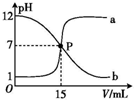 曲线 a 和 b 是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线.下列叙述中正确的是( )
曲线 a 和 b 是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线.下列叙述中正确的是( )| A. | 盐酸的物质的量浓度与 NaOH 溶液的物质的量浓度相等 | |
| B. | P 点时溶液中 c(Na+)=c(Cl-)=c(H+)=c(OH-) | |
| C. | 曲线 a 是盐酸滴定氢氧化钠溶液的滴定曲线 | |
| D. | 曲线 b 中滴定前 NaOH 溶液的体积为 150 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23gNa在氧气中完全燃烧失去NA个电子 | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LH2O含有NA个分子 | |
| D. | 1L0.5 mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
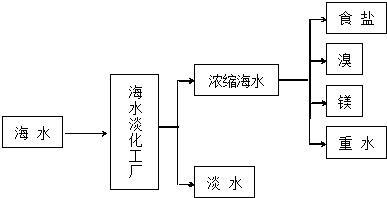
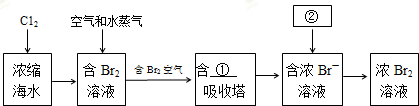
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
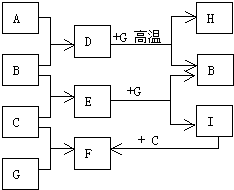 单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体.各物质间的转化关系如图所示(反应条件多数已略去).
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体.各物质间的转化关系如图所示(反应条件多数已略去). ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com