
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 将氯水滴入品红溶液 | 溶液褪色 | 氯水有漂泊作用 |
| ② | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省揭阳一中高一第一阶段考试化学试卷(带解析) 题型:实验题
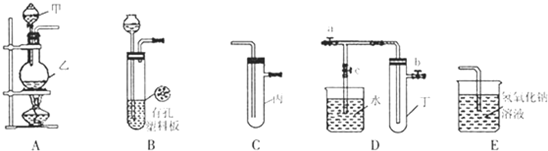
(8分)如图所示是中学化学实验中常见的装置,它有多种用途。
(1)若瓶中装有X溶液,将CO和CO2的混合气体由a管口通入, 用以除去CO2,则X为________。
| A.H2SO4 | B.NaOH | C.NaCl | D.HCl |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省泰州市姜堰区高三上学期期中考试化学试卷(解析版) 题型:实验题
(1)下列实验操作或对实验事实的描述不正确的有 (填序号)。
A.用托盘天平称量17.55g氯化钠晶体
B.碳酸钠溶液保存在带玻璃塞的试剂瓶
C.用干燥的pH试纸测定新制氯水的pH
D.使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大
E.向饱和FeCl3溶液中滴加少量NaOH溶液,可制取Fe(OH)3胶体
F.除去CO2气体中混有的少量HCl,可以将气体通入饱和碳酸氢钠溶液
(2)下图为中学化学实验中常见的实验装置



A B C
实验室常用装置A制备下表中气体,请将分液漏斗和圆底烧瓶中应装的化学试剂填写完整。
|
气体 |
O2 |
Cl2 |
NH3 |
|
分液漏斗中试剂 |
|
|
浓氨水 |
|
圆底烧瓶中试剂 |
|
KMnO4 |
|
可用B装置排液收集气体,气体应从该装置________(填“左”“右”)管口导进,倘若利用该装置收集Cl2,试剂瓶中盛放的试剂为 。
C装置用于处理多余气体对环境的污染,若利用该装置吸收Cl2,此时烧杯中发生反应的离子方程式为 。倘若该装置中仅仅盛放稀硫酸,通常不适合吸收氨气的原因是 ,若向烧杯中额外再加入一种液态有机物则可安全吸收氨气,这种有机物为 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省高一第一阶段考试化学试卷(解析版) 题型:实验题
(8分)如图所示是中学化学实验中常见的装置,它有多种用途。

(1)若瓶中装有X溶液,将CO和CO2的混合气体由a管口通入, 用以除去CO2,则X为________。
A.H2SO4 B.NaOH C.NaCl D.HCl
(2)若用排水法收集H2,则H2气体应从_______(填标号,下同)管口导入;若用排空气法收集CO2,则CO2气体应从________ 管口导入。
(3)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装有水的该装置,观察气泡产生的情况,以便调节供氧速率,此时氧气应从 管口导入。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com