
【题目】分部分短周期元素化合价与原子序数的关系可用右图表示。

(1)写出Q的元素符号 ,其原子结构示意图是 。
(2)写出X、Z形成的化合物与Y的最高价氧化物对应的水化物反应的离子方程式 ;
(3)写出两种W的含氧酸的化学式 、 ,请设计一种实验方案比较两种酸的酸性强弱 。
【答案】(1)Si;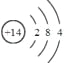 ;(2)Al2O3+2OH-=2AlO2-+H2O
;(2)Al2O3+2OH-=2AlO2-+H2O
(3)H2SO3;H2SO4;①用玻璃棒分别蘸取等浓度的两种酸,滴到pH试纸上,观察试纸红色的深浅,颜色深的是硫酸,颜色浅的是亚硫酸;②分别取等浓度的两种酸溶液,测量导电性的强弱,导电性强的是硫酸,导电性弱的是亚硫酸;③向亚硫酸钠中滴加硫酸,检验是否生成SO2气体,生成说明硫酸酸性强于亚硫酸,不生成说明硫酸酸性弱于亚硫酸。
【解析】试题分析:都是短周期元素,由表中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素;Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素;Z为+3价,原子序数大于Na为Al元素;Q为Si元素;W的化合价为+6、-2价,故W为S元素;R的最高正价为+7价,应为Cl元素。
(1)Q为Si元素;其原子结构示意图为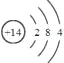 ,故答案为:Si;
,故答案为:Si;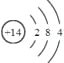 ;
;
(2)氧化铝与氢氧化钠反应生成偏铝酸钠溶液和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)硫的两种含氧酸的化学式分别为H2SO3、H2SO4;可以根据硫酸与亚硫酸钠能够反应生成二氧化硫气体;硫酸的酸性比亚硫酸强;硫酸是强电解质,亚硫酸是弱电解质等设计实验比较两种酸的酸性强弱,方案如下:①用玻璃棒分别蘸取等浓度的两种酸,滴到pH试纸上,观察试纸红色的深浅,颜色深的是硫酸,颜色浅的是亚硫酸;②分别取等浓度的两种酸溶液,测量导电性的强弱,导电性强的是硫酸,导电性弱的是亚硫酸;③向亚硫酸钠中滴加硫酸,检验是否生成SO2气体,生成说明硫酸酸性强于亚硫酸,不生成说明硫酸酸性弱于亚硫酸,故答案为:①用玻璃棒分别蘸取等浓度的两种酸,滴到pH试纸上,观察试纸红色的深浅,颜色深的是硫酸,颜色浅的是亚硫酸;②分别取等浓度的两种酸溶液,测量导电性的强弱,导电性强的是硫酸,导电性弱的是亚硫酸;③向亚硫酸钠中滴加硫酸,检验是否生成SO2气体,生成说明硫酸酸性强于亚硫酸,不生成说明硫酸酸性弱于亚硫酸。


科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g) + B(g) ![]() 2C(g)。经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4![]() 2NO2 △H > 0)
2NO2 △H > 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )

A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示。
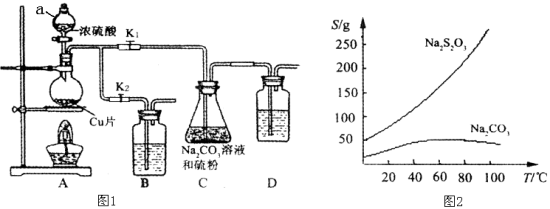
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:Cr2O72- + 6 I- + 14H+ = 2 Cr3+ + 3 I2 + 7 H2O;I2 + 2 S2O32- = S4O62-+2I-。则该废水中Ba2+的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 0.1 mol/L的BaCl2溶液与50 mL 0.2 mol/L的NaCl溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子浓度是( )
A.0.2 mol/L
B.0.01 mol/L
C.0.1 mol/L
D.0.02 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列变化:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。(填序号)
化学键没有被破坏的是________;仅发生离子键破坏的是_______ ; 仅发生共价键破坏的是________;既发生离子键又发生共价键破坏的是_______。
(2)已知1mol Si中含1mol Si—Si键。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/ kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
①已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列物质的熔点高低(填“>”或“<”):SiC________Si。
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
(1)W基态原子的价电子排布式为 。元素X、Y、Z的第一电离能由小到大顺序是 (填元素符号)。
(2)与XYZ-互为等电子体的一种分子为 (填化学式)。
(3)1 mol H2XZ3分子中含有σ键的数目为 。
(4)YH3极易溶于水的主要原因是 。
(5)尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
①尿素分子中C、N原子的杂化方式分别是 。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。根据价层电子对互斥理论推测NO3—的空间构型为 。
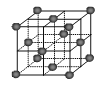
(6)CO2和NH3是制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1828年德国化学家维勒从无机物制得了有机物,打破了只能从有机物取得有机物的学说,这种有机物是( )
A. 纤维素 B. 树脂 C. 橡胶 D. 尿素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com