
【题目】硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示。
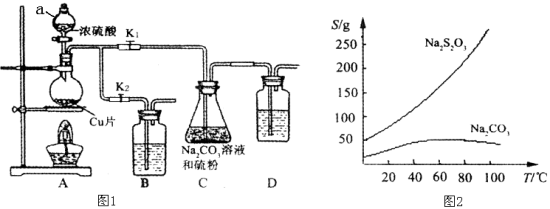
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:Cr2O72- + 6 I- + 14H+ = 2 Cr3+ + 3 I2 + 7 H2O;I2 + 2 S2O32- = S4O62-+2I-。则该废水中Ba2+的物质的量浓度为 。
【答案】(1)关闭K2打开K1,在D中加水淹没导管末端,双手捂住烧瓶(2分)
ACD(2分) 冷却结晶(2分)
(2)Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl(2分)
(3)0.0024mol·L-1(2分)
【解析】
试题分析:(1)根据装置图的特点,检查A、C装置气密性的操作是关闭K2打开K1,在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,若导气管末端有气泡冒出,松开热毛巾,在导气管中形成一段水柱,说明气密性良好;装置B、D的作用吸收SO2 ,防止污染空气,所以药品选用与SO2 反应的物质,下列物质中的NaOH、饱和NaHCO3溶液、酸性KMnO4溶液与SO2 反应,而浓硫酸不反应,选ADC;由于Na2S2O3在酸性溶液中不能稳定存在,容易分解,所以把pH控制在7~10之间;根据硫代硫酸钠的溶解度曲线图可知,硫代硫酸钠的溶解度随温度的升高而增大,所以获得产品的操作是将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品;(2)向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,说明S2O32-与Cl2反应生成SO42-,硫元素由+2价升高到+6价,则Cl2需得电子生成Cl-,该反应的化学方程式为Na2S2O3 + 4 Cl2 + 5 H2O = Na2SO4 + H2SO4 + 8 HCl;(3)根据题给信息可得如下关系式:Ba2+ ~ BaCrO4 ~ 0.5 Cr2O72- ~ 1.5 I2 ~ 3 Na2S2O3,则n(Ba2+)=1/3×0.010×18×1000-3 mol= 0.00006 mol,c(Ba2+) = 0.0006/0.025 mol·L-1=0.0024 mol·L-1。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】从对化合物分类方法出发,指出下列各组物质中与其他物质类型不同的一种物质。 a.Na2O、CaO、SO2、CuO。
b.NaCl、KCl、NaClO3、CaCl2。
c.HClO3、KClO3、HCl、NaClO3。
d.NaHCO3、Ca(HCO3)2、NH4HCO3、K2CO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
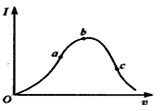
(1)“O”点导电能力为O的理由是 ;
(2)a、b、c三点溶液中c(H+)由小到大的顺序为 ;
(3)a、b、c三点中醋酸电离度最大的是 ;水电离程度最大的是 ;
(4)若使c点溶液的c(CH3COO-)提高,在如下措施中可采取 (填标号)。
A.加热
B.加盐酸
C.加冰醋酸
D.加入固体KOH
E.加水
F.加固体CH3COONa
G.加Zn粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离
B. 为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
C. “地沟油”禁止食用,但可以用来制肥皂
D. 用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分部分短周期元素化合价与原子序数的关系可用右图表示。

(1)写出Q的元素符号 ,其原子结构示意图是 。
(2)写出X、Z形成的化合物与Y的最高价氧化物对应的水化物反应的离子方程式 ;
(3)写出两种W的含氧酸的化学式 、 ,请设计一种实验方案比较两种酸的酸性强弱 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用反应TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
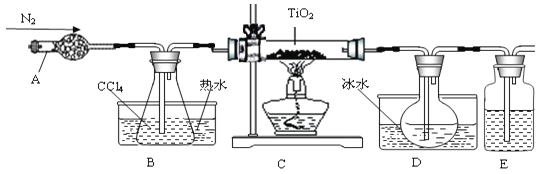
有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。
(2)反应结束后的操作包括:a停止通N2;b熄灭酒精灯;c冷却至室温。正确的顺序为 (填序号)。选择这种顺序的理由是 ; 欲分离D中的液态混合物,所采用操作的名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属防护的方法不正确的是
A. 对健身器材涂油漆以防止生锈 B. 将炊具制成铁铜合金而不用纯铁制品
C. 在铁制水管表面镀一层锌防止生锈 D. 自行车的钢圈上镀上一层铬防锈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com