
����Ŀ���������������������ʴ��ÿ����ʴ����ʧ�ĸֲ�ռ���������������ķ�֮һ��
(1)������ʴ��Ҫ��������ʴ���ø�ʴ�����еĵ缫��ӦʽΪ��������_____________________________ ��������______________________��
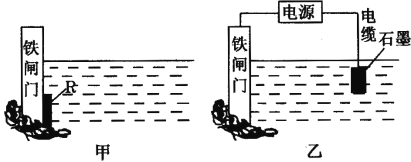
(2)Ϊ�˽���ijˮ����բ�ű���ʴ�����ʣ����Բ��ü�ͼ��ʾ�ķ��������к�����բ ���ϵĹ������R���Բ���___________��
A��ͭ B���� C��п D��ʯī
(3)��ͼ��ʾ�ķ���Ҳ���Խ�����բ�ŵĸ�ʴ���ʣ�������բ��Ӧ��������ֱ����Դ��___________����
(4)Ǧ�����ǻ�ѧ��Դ����缫���Ϸֱ�ΪPb��PbO2���������ҺΪϡ���ᣬ�ŵ�ʱ��ص��ܷ�ӦΪPb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O��������������жϣ�
��Ǧ���ص�����������_______(����Pb������PbO2��)�������ĵ缫��ӦʽΪ_______________________________________��
��Ǧ���ع���ʱ���������Һ��SO42������________��(����������������)����Һ��pH___________ (��������������С������������)��
���𰸡�O2 + 2H2O + 4e��= 4 OH�� Fe - 2e�� = Fe2+ C �� PbO2 Pb + SO42- - 2e��== PbSO4 �� ����
��������
(1)������ʴ��Ҫ��������ʴ���ø�ʴ�����еĵ缫��ӦʽΪ������������ԭ��Ӧ��������O2 + 2H2O + 4e��= 4 OH�� ����������������Ӧ��������Fe - 2e�� = Fe2+��
(2)Ӧ������Ƴ�ԭ��ص���������Ϊ���������õĽ�����ѡ����п���ԣ����������ƣ�������ˮ�������ҷ�Ӧ����������������ʴ��Ч������ѡC��
(3)ͼ����ʾ�ķ���Ϊ��ӵ�Դ�������������������ӵ�Դ�ĸ�����
(4)Ǧ�����ǻ�ѧ��Դ����缫���Ϸֱ�ΪPb��PbO2���������ҺΪϡ���ᣬ�ŵ�ʱ��ص��ܷ�ӦΪPb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O��������������жϣ�
��Ǧ���ص�����������PbO2 �������ĵ缫��ӦʽΪPb + SO42- - 2e��== PbSO4 ��
��Ǧ���ع���ʱ��SO42���������ӣ��������Һ��SO42��������Pb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O��Ӧ�������������ᣬ��Һ��pH����


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����ʵ����ģ�ⷴӦPCl3+SO2+Cl2![]() POCl3+SOCl2�Ʊ���Ҫ�Ļ���ԭ��
POCl3+SOCl2�Ʊ���Ҫ�Ļ���ԭ��![]() ��
��
��֪��![]() �۵�
�۵�![]() ���е�
���е�![]() ����ˮ����ˮ�⣬����
����ˮ����ˮ�⣬����![]() ��Ӧ��
��Ӧ��
![]() �۵�
�۵�![]() ���е�
���е�![]() ����ˮǿ��ˮ�⣬������
����ˮǿ��ˮ�⣬������![]() ��
��
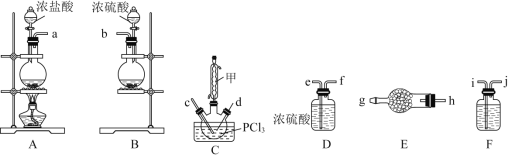
(1)װ��A�з�����Ӧ�����ӷ���ʽ��________��
(2)���ϸ������ӿڵ�����˳����![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ��װ��E��F����װ���Լ��ֱ���________��________��
��װ��E��F����װ���Լ��ֱ���________��________��
(3)װ��C�Ʊ�![]()
��������������________________________________��
�ڷ�Ӧ�¶ȿ�����![]() ����ԭ����________________________________��
����ԭ����________________________________��
��SOCl2����ˮ�ⷴӦ�Ļ�ѧ����ʽ��________________________________��
(4)��Ʒ������![]() ��ͨ��������·��ɲⶨ
��ͨ��������·��ɲⶨ![]() �ĺ�������ȡ
�ĺ�������ȡ![]() ��Ʒ�ڵ���ƿ����ȫˮ�⣬��ˮ��Һ���Ƴ�100mL��ȡ
��Ʒ�ڵ���ƿ����ȫˮ�⣬��ˮ��Һ���Ƴ�100mL��ȡ![]() ����ƿ�У�����
����ƿ�У�����![]() ��
��![]() ��Һ
��Һ![]() ���ټ�������������������ʹ�������л��︲�ǡ�����
���ټ�������������������ʹ�������л��︲�ǡ�����![]() ָʾ������
ָʾ������![]() ��Һ�ζ�������
��Һ�ζ�������![]() ���յ㣬��ƽ��ʵ�飬ƽ������KSCN��Һ
���յ㣬��ƽ��ʵ�飬ƽ������KSCN��Һ![]() ��
��![]() ��֪��
��֪��![]() ��
��![]()
�ٽ�ˮ��Һ���100mL�����õIJ����������˲��������ձ��⣬����________��
���������������dz������棬�ⶨ��Һ��![]() �����ʵ�����________
�����ʵ�����________![]() ����ƫ��������ƫС��������Ӱ����
����ƫ��������ƫС��������Ӱ����![]() ��
��
��POCl3�����ʵ�������Ϊ________��
![]() ��֪��
��֪��![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦN2+3H2 ![]() 2NH3�տ�ʼʱ��N2��Ũ��Ϊ3mol��L-1 ��H2��Ũ��Ϊ5mol��L-1��3min����NH3��Ũ��Ϊ0.6mol��L-1���ʱ���ڣ����з�Ӧ���ʱ�ʾ��ȷ����( )
2NH3�տ�ʼʱ��N2��Ũ��Ϊ3mol��L-1 ��H2��Ũ��Ϊ5mol��L-1��3min����NH3��Ũ��Ϊ0.6mol��L-1���ʱ���ڣ����з�Ӧ���ʱ�ʾ��ȷ����( )
A.v (NH3)= 0.1 mol�BL-1�Bmin-1B.v (N2) = 1.0 mol�BL-1�Bmin-1
C.v (H2) = 1.67 mol�BL-1�Bmin-1D.v (H2) = 0.3 mol�BL-1�Bmin-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ȷ����
A.AB3�͵ķ��ӿռ乹��һ��Ϊƽ��������
B.�縺�����Խ���Ԫ�ؼ�Խ���γ����Ӽ�
C.���Ӿ����У����Ӽ�������Խ����Խ�ȶ�
D.�������������˾�ʾ�ٵ�![]() �۵����Ų�Ϊ2s22p3
�۵����Ų�Ϊ2s22p3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I-���л�ԭ�ԣ�����ʳ���еĵ�Ԫ����Ҫ��KIO3����ʽ���ڣ�I-��I2��IO3-��һ�������¿ɷ�����ͼת����ϵ������˵������ȷ����
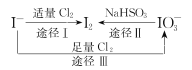
A.�õ���-KI��ֽ��ʳ�ɼ���ʳ���Ƿ�ӵ�
B.��ͼ��֪�����Ե�ǿ��˳��ΪCl2>IO3->I2
C.���������ĵ⣬;��I��;��IIת�Ƶ�����Ŀ֮��Ϊ5 ��2
D.;��III��Ӧ�����ӷ���ʽ��3Cl2+I-+3H2O=6Cl-+IO3-+6H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)25���£���ˮ��c(H��)��1��10��7 mol��L��1�����ʱc(OH��)��______________�����¶�����ˮ�м����ᣬʹ��Һ�е�c(H��)��1��10��3 mol��L��1�����ʱ��Һ��pH��_______________����25���£���ˮ�м���NaOH���壬ʹ��Һ��pH��13����ʱ��Һ��c(OH��)��___________�� �봿ˮ�ĵ������ƣ�Һ����Ҳ���������ĵ��룺2NH3 ![]() NH4+��NH2������д��Һ���ĵ���ƽ�ⳣ������ʽK =____________________________��
NH4+��NH2������д��Һ���ĵ���ƽ�ⳣ������ʽK =____________________________��
(2)ͬ���������ת���ķ�Ӧ���൱�ٶ�ת������������ʱ���ܲ���ȫ���ⶨʱ�� ���ѣ��ֿ����ݸ�˹���ɽ��м��㡣��֪��
P4 (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H1 ����283.2 kJ��mol��1 ��
4P (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H2 ����184.0kJ��mol��1 ��
���Ȼ�ѧ����ʽ���������ȶ�����ͬ���������� ______(��������������������) ����д������ת���ɺ����Ȼ�ѧ����ʽ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100 mL 1 mol��L��1�İ�ˮ��100 mL a mol��L��1����������ϣ����Է�Ӧ���Ⱥ�����仯�������й����۲���ȷ����
A. ����Ϻ���ҺpH��7����c(NH4��)��c(Cl��)
B. ��a��2����c(Cl��)>c(NH4��)>c(H��)>c(OH��)
C. ��a��0.5����c(NH4��)>c(Cl��)>c(OH��)>c(H��)
D. ����Ϻ���Һ����c(H��)��c(OH��)��c(NH3��H2O)������Ƴ�a��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ϩ�ܷ�������ת��:
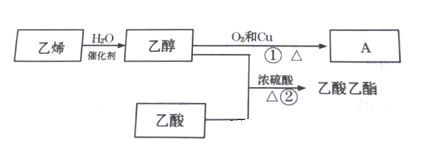
��1��A������Ϊ_____________��
��2���ٵķ�Ӧ����ʽ___________________���ٵķ�Ӧ����___________��
��3���ڵķ�Ӧ����ʽ_____________���ڵķ�Ӧ������__________________��
��4��ŨH2SO4������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��Cʱ����10mL0.10mol��L-1��һԪ����HA(Ka =1.0��10-3)����μ���0.10mol��L-1NaOH��Һ����ҺpH�����NaOH��Һ����ı仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A.a��ʱ��c(HA)+c(OH-)=c(Na+)+c(H+)
B.��Һ��a���b��ʱˮ�ĵ���̶���ͬ
C.b��ʱ��c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mLʱ��c(Na+)>c(A-)>c(H+)>c(HA)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com