
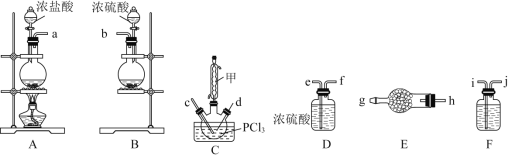
【题目】某兴趣小组在实验室模拟反应PCl3+SO2+Cl2![]() POCl3+SOCl2制备重要的化工原料
POCl3+SOCl2制备重要的化工原料![]() 。
。
已知:![]() 熔点
熔点![]() ,沸点
,沸点![]() ,遇水极易水解,易与
,遇水极易水解,易与![]() 反应;
反应;
![]() 熔点
熔点![]() ,沸点
,沸点![]() ,遇水强烈水解,能溶于
,遇水强烈水解,能溶于![]() 。
。
(1)装置A中发生反应的离子方程式是________。
(2)以上各仪器接口的连接顺序是![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ,装置E、F中所装的试剂分别是________、________。
,装置E、F中所装的试剂分别是________、________。
(3)装置C制备![]()
①仪器甲的作用是________________________________;
②反应温度控制在![]() ,其原因是________________________________;
,其原因是________________________________;
③SOCl2发生水解反应的化学方程式是________________________________。
(4)产品含杂质![]() ,通过佛尔哈德法可测定
,通过佛尔哈德法可测定![]() 的含量:称取
的含量:称取![]() 样品在碘量瓶中完全水解,将水解液配制成100mL,取
样品在碘量瓶中完全水解,将水解液配制成100mL,取![]() 于锥形瓶中,加入
于锥形瓶中,加入![]() 的
的![]() 溶液
溶液![]() ,再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入
,再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入![]() 指示剂,用
指示剂,用![]() 溶液滴定过量的
溶液滴定过量的![]() 至终点,做平行实验,平均消耗KSCN溶液
至终点,做平行实验,平均消耗KSCN溶液![]() 。
。![]() 已知:
已知:![]() ,
,![]()
①将水解液配成100mL,需用的玻璃仪器除了玻璃棒、烧杯外,还有________;
②若无硝基苯覆盖沉淀表面,测定溶液中![]() 的物质的量将________
的物质的量将________![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]() ;
;
③POCl3的物质的量分数为________。
![]() 已知:
已知:![]() ,
,![]()
【答案】![]()
![]()
![]()
![]() j e f 无水
j e f 无水![]() 或
或![]() 或硅胶 饱和食盐水
或硅胶 饱和食盐水![]() 或饱和NaCl溶液
或饱和NaCl溶液![]() 冷凝回流
冷凝回流![]() ,提高产率,导气 温度太低,反应速率太慢,温度太高,
,提高产率,导气 温度太低,反应速率太慢,温度太高,![]() 、
、![]() 挥发
挥发 ![]() 或
或![]()
![]() 容量瓶、胶头滴管 偏小
容量瓶、胶头滴管 偏小 ![]()
【解析】
![]() 为制备氯气的装置,据此解答;
为制备氯气的装置,据此解答;
![]() 装置制备氯气,其中混有氯化氢和水蒸气,需要经过F装置中的饱和食盐水除去氯化氢,通过D装置中的浓硫酸干燥,再通入C中,为保证除杂、干燥充分,导气管在洗气瓶中均为长进短出,由装置B制取二氧化硫,需通过E中干燥剂干燥后再通入C中反应,;装置E中为固体干燥剂,装置F是除去氯化氢,据此解答;
装置制备氯气,其中混有氯化氢和水蒸气,需要经过F装置中的饱和食盐水除去氯化氢,通过D装置中的浓硫酸干燥,再通入C中,为保证除杂、干燥充分,导气管在洗气瓶中均为长进短出,由装置B制取二氧化硫,需通过E中干燥剂干燥后再通入C中反应,;装置E中为固体干燥剂,装置F是除去氯化氢,据此解答;
![]() 仪器甲为冷凝管,其作用是冷凝回流,据此解答;
仪器甲为冷凝管,其作用是冷凝回流,据此解答;
![]() 温度过高,
温度过高,![]() 、
、![]() 会大量挥发,导致产量降低,温度过低,反应速率会变慢,据此解答;
会大量挥发,导致产量降低,温度过低,反应速率会变慢,据此解答;
![]() 发生水解反应生成二氧化硫和盐酸,据此解答;
发生水解反应生成二氧化硫和盐酸,据此解答;
![]() 配置溶液需用的玻璃仪器有玻璃棒、烧杯、100mL容量瓶、胶头滴管,据此解答;
配置溶液需用的玻璃仪器有玻璃棒、烧杯、100mL容量瓶、胶头滴管,据此解答;
![]() 硝基苯难溶于水,生成的AgCl沉淀用硝基苯覆盖,目的是防止在滴加KSCN溶液时AgCl沉淀转化为/span>AgSCN沉淀,若无硝基苯覆盖沉淀表面,消耗的KSCN溶液将偏多,测定溶液中
硝基苯难溶于水,生成的AgCl沉淀用硝基苯覆盖,目的是防止在滴加KSCN溶液时AgCl沉淀转化为/span>AgSCN沉淀,若无硝基苯覆盖沉淀表面,消耗的KSCN溶液将偏多,测定溶液中![]() 的物质的量将偏小,据此解答;
的物质的量将偏小,据此解答;
![]() ,沉淀
,沉淀![]() 溶液中
溶液中![]() 消耗的
消耗的![]() 的物质的量为:
的物质的量为:![]() ,
,![]() ,设样品中
,设样品中![]() 的物质的量为x,
的物质的量为x,![]() 的物质的量为y,则:
的物质的量为y,则: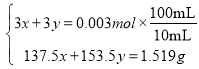 ,据此解答。
,据此解答。
![]() 为制备氯气的装置,发生反应的离子方程式是
为制备氯气的装置,发生反应的离子方程式是![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]() ;
;
![]() 装置制备氯气,其中混有氯化氢和水蒸气,需要经过F装置中的饱和食盐水除去氯化氢,通过D装置中的浓硫酸干燥,再通入C中,为保证除杂、干燥充分,导气管在洗气瓶中均为长进短出,由装置B制取二氧化硫,需通过E中干燥剂干燥后再通入C中反应,故连接顺序为
装置制备氯气,其中混有氯化氢和水蒸气,需要经过F装置中的饱和食盐水除去氯化氢,通过D装置中的浓硫酸干燥,再通入C中,为保证除杂、干燥充分,导气管在洗气瓶中均为长进短出,由装置B制取二氧化硫,需通过E中干燥剂干燥后再通入C中反应,故连接顺序为![]() ;装置E中为固体干燥剂,可选用无水
;装置E中为固体干燥剂,可选用无水![]() 或
或![]() 或硅胶,装置F是除去氯化氢,选用饱和食盐水
或硅胶,装置F是除去氯化氢,选用饱和食盐水![]() 或饱和NaCl溶液
或饱和NaCl溶液![]() ,故答案为:
,故答案为:![]() ;j;
;j;
e;f;无水![]() 或
或![]() 或硅胶;饱和食盐水
或硅胶;饱和食盐水![]() 或饱和NaCl溶液
或饱和NaCl溶液![]() ;
;
![]() 仪器甲为冷凝管,其作用是冷凝回流
仪器甲为冷凝管,其作用是冷凝回流![]() ,提高产率,导气,故答案为:冷凝回流
,提高产率,导气,故答案为:冷凝回流![]() ,提高产率,导气;
,提高产率,导气;
![]() 中反应温度控制在
中反应温度控制在![]() ,因为温度过高,
,因为温度过高,![]() 、
、![]() 会大量挥发,导致产量降低,温度过低,反应速率会变慢,故答案为:温度太低,反应速率太慢,温度太高,
会大量挥发,导致产量降低,温度过低,反应速率会变慢,故答案为:温度太低,反应速率太慢,温度太高,![]() 、
、![]() 挥发;
挥发;
![]() 发生水解反应的化学方程式是
发生水解反应的化学方程式是![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
![]() 将水解液配成100mL,需用的玻璃仪器有玻璃棒、烧杯、100mL容量瓶、胶头滴管,故答案为:
将水解液配成100mL,需用的玻璃仪器有玻璃棒、烧杯、100mL容量瓶、胶头滴管,故答案为:![]() 容量瓶、胶头滴管;
容量瓶、胶头滴管;
![]() 硝基苯难溶于水,生成的AgCl沉淀用硝基苯覆盖,目的是防止在滴加KSCN溶液时AgCl沉淀转化为AgSCN沉淀,若无硝基苯覆盖沉淀表面,消耗的KSCN溶液将偏多,测定溶液中
硝基苯难溶于水,生成的AgCl沉淀用硝基苯覆盖,目的是防止在滴加KSCN溶液时AgCl沉淀转化为AgSCN沉淀,若无硝基苯覆盖沉淀表面,消耗的KSCN溶液将偏多,测定溶液中![]() 的物质的量将偏小,故答案为:偏小;
的物质的量将偏小,故答案为:偏小;
![]() ,沉淀
,沉淀![]() 溶液中
溶液中![]() 消耗的
消耗的![]() 的物质的量为:
的物质的量为:![]() ,
,![]() ,设样品中
,设样品中![]() 的物质的量为x,
的物质的量为x,![]() 的物质的量为y,则:
的物质的量为y,则: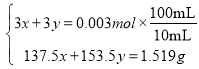 ,解得
,解得![]() ,
,![]() 的物质的量分数为
的物质的量分数为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】(1)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞 (如图1)。
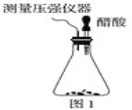
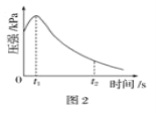
从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了____________腐蚀,此时,碳粉表面发生的电极反应式是____________。
(2)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是______。
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的总反应式相同
(3)电动车采用了一种高效耐用的新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
①该电池放电时负极电极反应式为_________;
②充电时阳极电极反应式为_______。
(4)下列描述中,符合生产实际的是(______)
A. 电解食盐水制得金属钠 B. 电解熔融氯化铝制取金属铝,用石墨作阳极
C. 一氧化碳高温还原铁矿石制得铁 D.电解熔融氧化镁制取金属镁,用铁作阳极
(5)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)(______)
A.阴极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50 mol·L-1NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:

②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是_________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_____________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法错误的是( )
A. c(H+)为1.0×10-4mol·L-1的醋酸溶液的pH=4
B. 0.1 mol·L-1某酸溶液的pH=1
C. 0.01 mol·L-1氨水的pH<12
D. pH=3的醋酸溶液的浓度大于1.0×10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )
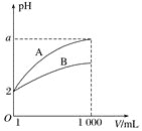
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液的酸性强
C.a=5时,A是强酸,B是弱酸
D.一定有关系:5>a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应:A(g)+2B(s)C(s)+D(g) ΔH>0(正反应为吸热反应)。下图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是( )

A.②③
B.①②
C.③④
D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-据此判断以下叙述错误的是
NH4++NH2-据此判断以下叙述错误的是
A. 液氨中含有NH3、NH4、NH2-三种微粒
B. 一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
C. 液氨的电离达到平衡c(NH3)= c(NH4+)=c(NH2-)
D. 只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:正极:_____________________________ ;负极:______________________。
(2)为了降低某水库铁闸门被腐蚀的速率,可以采用甲图所示的方案,其中焊接在闸 门上的固体材料R可以采用___________。
A.铜 B.钠 C.锌 D.石墨
(3)乙图所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的___________极。
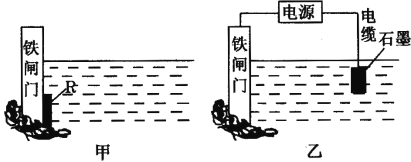
(4)铅蓄电池是化学电源,其电极材料分别为Pb和PbO2,电解质溶液为稀硫酸,放电时电池的总反应为Pb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O。根据上述情况判断:
①铅蓄电池的正极材料是_______(填“Pb”或“PbO2”),负极的电极反应式为_______________________________________。
②铅蓄电池工作时,电解质溶液中SO42﹣移向________极(填“负”或“正”),溶液的pH___________ (填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com