
����Ŀ��ʵ������Ҫ����0.50 mol��L��1NaCl��Һ480 mL�������в������������ʵ������֣���ʹ��������������
(1)ѡ����������ɱ�ʵ��������������У�������ƽ(��ȷ��0.1 g)��ҩ�ס��ձ�����������________��________�Լ�����������Ƭ��ֽ��
(2)���㡣���Ƹ���Һ��ȡNaCl����________g��
(3)������
����ƽ��ƽ֮��Ӧ����ƽ���������ij��λ�ã�������ͼ����һ�����߱���������Ե������λ�ã�

�ڳ���������NaCl����Ӧ������ƽ��________(����̡������̡�)��
�۳�����ϣ���ҩƷ�����ձ��С�
(4)�ܽ⡢��ȴ���ò�ʵ������Ҫʹ�ò�������Ŀ����_________________��
(5)ת�ơ�ϴ�ӡ���ת��ʱӦʹ��________��������Ҫϴ���ձ�2��3����Ϊ��_____________��
(6)���ݣ�ҡ�ȡ�
(7)����õ���Һ����һ��ʱ�����ָ�����Լ�ƿ�������ñ�ǩ��ע�����Ƶ�ʱ�䡢��Һ���Ƽ�Ũ�ȡ�
(8)�����ƹ����У�ijѧ���۲춨��ʱҺ�������ͼ��ʾ��������Һ��Ũ�Ȼ�________(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��

���𰸡�500 mL����ƿ��ͷ�ι�14.6���̽��裬����NaCl�ܽⲣ������֤����ȫ��ת��������ƿ��ƫ��
��������
���⣨1������һ�����ʵ���Ũ�ȵ���Һ��Ҫ�õ�������ƽ����Ͳ�����ձ���������������ƿ����ͷ�ιܣ�����ƿ�Ĺ����100mL��250mL��500mL��1000mL�������Ҫ500mL����ƿ�ͽ�ͷ�ιܣ�
��2����Ҫ�Ȼ��Ƶ�����Ϊm��NaCl����500��10��3��0.5��58.5g=14.6g��
��3������������ƽ��ʹ����������������֪NaCl���������ƽ�����̣�
��4���ܽ�ʹ�ò��������н��裬�����Ȼ��Ƶ��ܽ⣻
��5��ת��ʱӦʹ�ò�������������ֹ��Һ�������棬�������Ũ�Ȳ�����Ҫϴ���ձ��Ͳ�����2��3�Σ�Ϊ�˱�֤����ȫ��ת��������ƿ�У�
��7������õ���Һ����һ��ʱ�����ָ�����Լ�ƿ�������ñ�ǩ��ע�����Ƶ�ʱ�䡢Ũ�ȡ����ƣ�
��8�����Ӷ�����������Һ����������ʵ����ʵ������䣬���Ũ�Ƚ�ƫ�͡�


 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I��һ�������Ʊ�����Ѫѹҩ�ﰢ��������м��塣��ϳ�·������ͼ����:

��1��I���������������____��____��
��2��B��C�ķ�Ӧ������____��
��3����֪B�ķ���ʽΪC9H10O2��д��B�Ľṹ��ʽ��____��
��4��д��ͬʱ��������������E��һ��ͬ���칹��Ľṹ��ʽ��____��
�ٺ��ж���������
������NaHCO3��Ӧ����CO2��
�۷�������5�ֲ�ͬ��ѧ�������⡣
��5��������ͼ�л�����AΪԭ�Ͽ�ͨ���IJ�ת���Ʊ�������![]() �������α���ѧ����֪ʶ�ں����ϲ���١��ܵķ�Ӧ�Լ��ͷ�Ӧ��������ʽ��
�������α���ѧ����֪ʶ�ں����ϲ���١��ܵķ�Ӧ�Լ��ͷ�Ӧ��������ʽ��![]() ��______��
��______��

��6����д����C2H5OH��![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ�______��
�ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ�______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܸ߷���P�ĺϳ�·�����£�

��1��A�ķ���ʽ��C7H8����ṹ��ʽ��________________________��
��2���Լ�a��____________________��
��3����Ӧ�۵Ļ�ѧ����ʽ��_________________________________________________��
��4��E�ķ���ʽ��C6H10O2��E�к��еĹ����ţ�_________________________��
��5����Ӧ�ܵķ�Ӧ������____________________________��
��6����Ӧ�ݵĻ�ѧ����ʽ��_________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ A��B��D��H ����ѧ��ѧ�г����ĵ��ʣ����� A��D Ϊ���壬J Ϊ��ɫ��Һ��ת����ϵ����(���������P��Ӧ��������ȥ)��
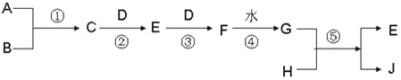
��1���� B Ϊ����ʱ�����ò������ֱ�պȡ C��G ��Ũ��Һ��ʹ���ǿ���ʱ���а������ɡ���
����д���������ʵĻ�ѧʽC__________��F______________��
������Һ�У���������������ӵķ���__________________��
��2����BΪ����ʱ����֪ E ��һ�ֳ����Ŀ�����Ⱦ��ҽ� C �� E ��Ͽ����ɵ���ɫ���� B��д�� G �� H ��Ӧ�Ļ�ѧ����ʽ_____��������������E�ķ���_____��
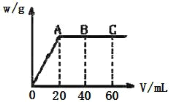
��3����G �ֱ���HNO3 ��H2SO4��ȡ���ߵĻ����Һ 10 mL������0.25molL��1Ba(OH)2 ��Һʱ�����ɳ��������� w��g���� Ba(OH)2 ��Һ����� V��mL���Ĺ�ϵ��ͼ��ʾ��C ����Һ�����ԣ�����ԭ���Һ�� H2SO4 �����ʵ���Ũ��Ϊ_________mol��L-1��HNO3 �����ʵ���Ũ��Ϊ_____________mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������б仯�У������ڻ�ѧ�仯���ǣ� ��
A. SO2ʹƷ����Һ��ɫ B. ��ˮʹ��ɫʯ����Һ��ɫ
C. SO2ʹ���������Һ��ɫ D. ����̿ʹīˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵؿ�����Ҫ��NaIO3����ʽ���ڣ��ں�ˮ����Ҫ��I����ʽ���ڣ���������֮���ת����ϵ��ͼ��ʾ����֪���������ʵ����������˵������ȷ����

A. ��I����Һ��ͨ��Cl2��������Һ���������Һһ������
B. ;��II��������1 mol I2������1 mol NaHSO3
C. �����Ե�ǿ��˳��ΪCl2>I2>IO3
D. һ�������£�I��IO3��������I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���25��ʱ��������ĵ���ƽ�ⳣ����
��ѧʽ | HA��A����ij������� | HNO2 | H2CO3 |
Ka | Ka��4.9��10��10 | Ka��4.6��10��4 | Ka1��4.1��10��7 Ka2��5.6��10��11 |
�ش��������⣺
��1�������ӷ���ʽ��ʾNaNO2��Һ�ʼ��Ե�ԭ��____________________��
��2��A����CO32����HCO3����ˮ�н��H+�������ɴ�С��˳��Ϊ____________��
��3��25��ʱ�������ʵ���Ũ�ȵ�HA��NaA�Ļ����Һ�ʼ��ԣ���û����Һ�и�����Ũ�ȴ�С��ϵΪ________________�����ͻ����Һ�ʼ��Ե�ԭ��_________________________________��
��4��д��NaA��Һ��ͨ����CO2�����ӷ���ʽ_______________________________________��
��5��ijͬѧ��Na2CO3��NaHCO3��Һ��������ͼ��ʾʵ����

�� ��ַ�Ӧ��a�Թ��д������ڵ�������_______________________________________��
�� �����ӷ���ʽ��ʾb�Թ��з����ķ�Ӧ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������������ڷ�Ӧ������������ǣ� ��
A. �������������ķ�ӦB. �Ȼ����Ba(OH)2��8H2O��Ӧ
C. пƬ��ϡ���ᷴӦD. ������ˮ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com