
【题目】对于可逆反应 2AB3(g) ![]() A2(g) + 3B2(g) ; ΔH>0,下列图像正确的是
A2(g) + 3B2(g) ; ΔH>0,下列图像正确的是
A. B.
B.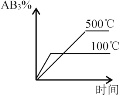
C. D.
D.
【答案】D
【解析】
可逆反应 2AB3(g) ![]() A2(g) + 3B2(g)正向为吸热、气体体积增大的反应,升高温度,平衡正向移动,增大压强平衡逆向移动,据此分析判断。
A2(g) + 3B2(g)正向为吸热、气体体积增大的反应,升高温度,平衡正向移动,增大压强平衡逆向移动,据此分析判断。
A. 升高温度,正逆反应速率均增大,但该反应为吸热反应,升高温度,平衡正向移动,因此v(正)>v(逆),A项错误;
B. 升高温度,平衡正向移动,AB3(g)的含量减小,反应达到平衡状态的时间缩短,B项错误;
C. 增大压强,平衡逆向移动,AB3(g)的含量增大,升高温度,平衡正向移动,AB3(g)的含量减小,C项错误;
D. 增大压强,平衡逆向移动,AB3(g)的含量增大,温度升高,平衡正向移动,AB3(g)的含量减小,D项正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)2HI(g)△H=-9.48kJmol-1
②H2(g)+I2(?)2HI(g)△H=+26.48kJmol-1
下列判断不正确的是( )
A.![]() 中的I2为气态,
中的I2为气态,![]() 中的I2为固态
中的I2为固态
B.![]() 的反应物总能量比
的反应物总能量比![]() 的反应总能量低
的反应总能量低
C.1mol固态碘升华时将吸热35.96kJ
D.反应![]() 的产物比反应
的产物比反应![]() 的产物热稳定性更好
的产物热稳定性更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示A、B、C、D、E五种仪器:
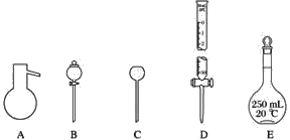
(1)请选择下列仪器名称的序号,填入相应的横线上:
①蒸馏烧瓶 ②碱式滴定管 ③圆底烧瓶 ④长颈漏斗⑤分液漏斗 ⑥酸式滴定管 ⑦容量瓶
A:__________,B:__________,C:__________,D:________,E:________。
(2)上述A~E五种仪器中,使用前必须检漏的有________,组装气体发生器必须液封的是________。
(3)下列仪器中,
![]()
在灼烧固体物质时必须用到的仪器是________________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠![]() 是一种重要的化工产品,将
是一种重要的化工产品,将![]() 通入
通入![]() 和
和![]() 混合溶液中可制得
混合溶液中可制得![]() 。其制备装置如下图所示。
。其制备装置如下图所示。

(1)![]() 中反应的化学方程式为________。
中反应的化学方程式为________。
(2)为保证![]() 和
和![]() 得到充分利用,两者的物质的量之比应为________。
得到充分利用,两者的物质的量之比应为________。
(3)为了保证硫代硫酸钠的产量,实验中通入的![]() 不能过量,原因是________。
不能过量,原因是________。
(4)待![]() 和
和![]() 完全消耗后,结束反应。过滤B中的混合物,滤液经过________、________
完全消耗后,结束反应。过滤B中的混合物,滤液经过________、________![]() 填操作名称
填操作名称![]() 、过滤、洗涤、干燥,得到
、过滤、洗涤、干燥,得到![]() 晶体。
晶体。
(5)称取![]() 产品
产品![]() ,相对分子质量为
,相对分子质量为![]() ,配成250mL溶液,取
,配成250mL溶液,取![]() 溶液,以淀粉作指示剂,用
溶液,以淀粉作指示剂,用![]() 碘的标准溶液滴定。
碘的标准溶液滴定。![]() 反应原理为:
反应原理为:![]() ,忽略
,忽略![]() 与
与![]() 反应
反应![]() 。
。
①滴定终点的现象为________。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则![]() ________,产品的纯度为________。
________,产品的纯度为________。

实验序号 | 消耗标准溶液体积 |
1 |
|
2 |
|
3 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室模拟反应PCl3+SO2+Cl2![]() POCl3+SOCl2制备重要的化工原料
POCl3+SOCl2制备重要的化工原料![]() 。
。
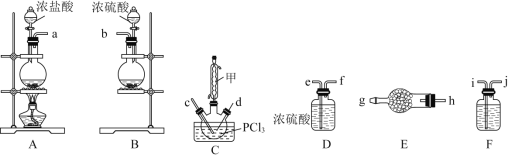
已知:![]() 熔点
熔点![]() ,沸点
,沸点![]() ,遇水极易水解,易与
,遇水极易水解,易与![]() 反应;
反应;
![]() 熔点
熔点![]() ,沸点
,沸点![]() ,遇水强烈水解,能溶于
,遇水强烈水解,能溶于![]() 。
。
(1)装置A中发生反应的离子方程式是________。
(2)以上各仪器接口的连接顺序是![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ,装置E、F中所装的试剂分别是________、________。
,装置E、F中所装的试剂分别是________、________。
(3)装置C制备![]()
①仪器甲的作用是________________________________;
②反应温度控制在![]() ,其原因是________________________________;
,其原因是________________________________;
③SOCl2发生水解反应的化学方程式是________________________________。
(4)产品含杂质![]() ,通过佛尔哈德法可测定
,通过佛尔哈德法可测定![]() 的含量:称取
的含量:称取![]() 样品在碘量瓶中完全水解,将水解液配制成100mL,取
样品在碘量瓶中完全水解,将水解液配制成100mL,取![]() 于锥形瓶中,加入
于锥形瓶中,加入![]() 的
的![]() 溶液
溶液![]() ,再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入
,再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入![]() 指示剂,用
指示剂,用![]() 溶液滴定过量的
溶液滴定过量的![]() 至终点,做平行实验,平均消耗KSCN溶液
至终点,做平行实验,平均消耗KSCN溶液![]() 。
。![]() 已知:
已知:![]() ,
,![]()
①将水解液配成100mL,需用的玻璃仪器除了玻璃棒、烧杯外,还有________;
②若无硝基苯覆盖沉淀表面,测定溶液中![]() 的物质的量将________
的物质的量将________![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]() ;
;
③POCl3的物质的量分数为________。
![]() 已知:
已知:![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向负极移动.
C. 充电过程中,电池正极材料的质量减少
D. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)=CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠 溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_____________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃下,纯水中c(H+)=1×10-7 mol·L-1,则此时c(OH-)=______________,该温度下向纯水中加盐酸,使溶液中的c(H+)=1×10-3 mol·L-1,则此时溶液的pH=_______________。若25℃下,向纯水中加入NaOH固体,使溶液的pH=13,此时溶液中c(OH-)=___________。 与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 ![]() NH4++NH2-,请写出液氨的电离平衡常数表达式K =____________________________。
NH4++NH2-,请写出液氨的电离平衡常数表达式K =____________________________。
(2)同素异形体相互转化的反应热相当少而转化速率慢,有时还很不完全,测定时很 困难,现可依据盖斯定律进行计算。已知:
P4 (白磷,s) + 5O2 (g) = 2P2O5 (s); △H1 =-283.2 kJ·mol-1 ①
4P (红磷,s) + 5O2 (g) = 2P2O5 (s); △H2 =-184.0kJ·mol-1 ②
由热化学方程式看来,更稳定的磷的同素异形体是 ______(填“白磷”或“红磷”) ,试写出白磷转化成红磷的热化学方程式______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com