
科目:高中化学 来源: 题型:实验题
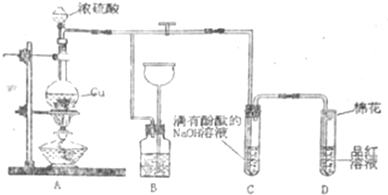
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
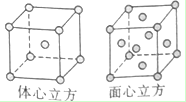 X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题:
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题: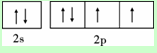 ,其第一电离能在同周期元素中由大到小排第4 位.
,其第一电离能在同周期元素中由大到小排第4 位.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
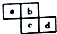
| A. | 原子半径:c>d>a>b | |
| B. | 原子序数d可能是a的3倍 | |
| C. | 最高价含氧酸的酸性c可能比d强 | |
| D. | 四种元素的氢化物可能是18电子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 价层电子对互斥理论将分子分成两类:中心原子有孤电子对的和无孤电子对的 | |
| B. | 价层电子对互斥理论既适用于单质分子,也适用于化合物分子 | |
| C. | sp3杂化轨道是由一个原子中能量相近的s轨道和p轨道通过杂化形成的一组能量相近的新轨道 | |
| D. | AB2型共价化合物的中心原子A采取的杂化方式可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
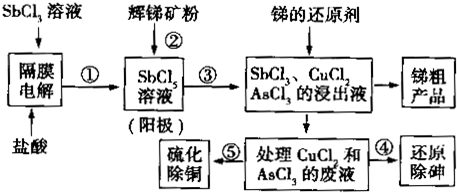
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 今年5月18日桐庐县320国道化学品运输车侧翻造成1,1,2,2-四氯乙烷泄漏,该有机物是一种重要的有机溶剂,不溶于水且密度比水小 | |
| C. | 如图所示的有机物分子式为C14H12O2,此有机物能与NaHCO3溶液反应放出CO2气体 | |
| D. | 化合物 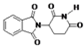 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com