
 X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题:
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题: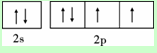 ,其第一电离能在同周期元素中由大到小排第4 位.
,其第一电离能在同周期元素中由大到小排第4 位.分析 X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,则X为H元素,Y元素基态原子核外未成对电子数为2,且X与Y形成的化合物在常温下为常见的液体R,则Y为O元素,R为H2O,Z元素原子最外电子层上s、p电子数相等,且Z的原子序数大于氧,所以Z为Si元素,W基态原子3d轨道的电子数是4s轨道电子数的3倍,则W的外围电子排布为3d64s2,所以W为Fe元素,据此答题;
解答 解:X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,则X为H元素,Y元素基态原子核外未成对电子数为2,且X与Y形成的化合物在常温下为常见的液体R,则Y为O元素,R为H2O,Z元素原子最外电子层上s、p电子数相等,且Z的原子序数大于氧,所以Z为Si元素,W基态原子3d轨道的电子数是4s轨道电子数的3倍,则W的外围电子排布为3d64s2,所以W为Fe元素,
(1)Y为O元素,价电子数为6,所以Y基态原子的价电子排布图为  ,其第一电离能在同周期元素中小于N、F、Ne,所以由大到小排第4位,
,其第一电离能在同周期元素中小于N、F、Ne,所以由大到小排第4位,
故答案为: ;4;
;4;
(2)W为Fe元素,W的元素名称为铁,其基态原子核外有26个电子,所以有26种空间运动状态不同的电子,
故答案:铁;26;
(3)R为H2O,R的中心原子价层电子对数为$\frac{6+2}{2}$=4,所以采取的杂化方式为sp3杂化,水的一个等电子体为H2S(或NH2-),
故答案为:sp3;H2S(或NH2-);
(4)Z为Si元素,Y为O元素,Z与Y在一定条件下可形成高硬度的化合物为二氧化硅,该化合物的晶体类型为原子晶体,其由Z、Y构成的最小环为12元环,故答案为:原子晶体;12;
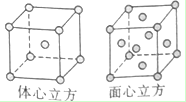
(5)体心立方晶胞中铁原子个数=1+8×$\frac{1}{8}$=2;面心立方晶胞中实际含有的Fe原子个数=6×$\frac{1}{6}$+8×$\frac{1}{8}$=4,设体心立方中晶胞的棱长为x,铁原子的直径为A,则3x2=(2A)2,解得x=$\frac{2\sqrt{3}A}{3}$;铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长=$\sqrt{2}A$,其晶胞体积=2$\sqrt{2}$A3.
体心立方的密度与面心立方的密度之比=$\frac{2m}{(\frac{2\sqrt{3}}{3}{A)}^{3}}$:$\frac{4m}{2\sqrt{2}{A}^{3}}$=3$\root{3}{6}$:8,故答案为:3$\root{3}{6}$:8.
点评 本题综合考查物质结构与性质,涉及核外电子排布规律、杂化理论、等电子体、晶胞的密度等知识点,难点是计算晶胞的密度之比,能正确解答晶胞的体积是解本题的关键,知道体心立方和面心立方中哪三个原子紧密相连即可分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 950mL,111.2g | B. | 500mL,117g | C. | 1000mL,l17g | D. | 任意规格,117g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与氢氧化钠溶液的反应:H++OH-=H2O | |
| B. | 钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| C. | 氯气与氯化亚铁溶液的反应:Cl2+2Fe2+=2Cl-+2Fe3+ | |
| D. | 碳酸钙溶液与足量稀盐酸的反应:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5(2.5微米以下的细颗粒物)主要来自化石燃料的燃烧 | |
| C. | 处理废水时加入明矾作为消毒剂对水进行杀菌消毒 | |
| D. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 酚类-OH
酚类-OH 羧酸-COOH--
羧酸-COOH-- 醛类
醛类

 酯类
酯类
| A. | (1)(2)(3)(4)(5) | B. | (2)(4) | C. | (2)(3)(4) | D. | (2)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打作发酵粉焙制糕点 | B. | 用甲醛溶液浸泡海产品 | ||
| C. | 用工业石蜡给水果上蜡“美容” | D. | 用工业酒精勾兑饮用酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
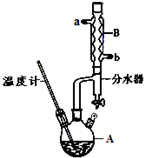 苯甲酸乙酯(C9H10O2)是一种无色透明液体,不溶于水,稍有水果香味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等.
苯甲酸乙酯(C9H10O2)是一种无色透明液体,不溶于水,稍有水果香味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等.
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸 | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com