
 苯甲酸乙酯(C9H10O2)是一种无色透明液体,不溶于水,稍有水果香味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等.
苯甲酸乙酯(C9H10O2)是一种无色透明液体,不溶于水,稍有水果香味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等.
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸 | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
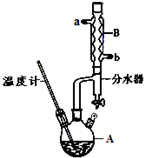
分析 (1)根据装置图可知仪器A的名称;加入圆底烧瓶中液体的体积大约为60mL,而烧瓶所能盛放溶液的体积不超过烧瓶体积的 $\frac{2}{3}$,据此判断圆底烧瓶的规格;
(2)苯甲酸在100℃会迅速升华,所以制备苯甲酸乙酯时,温度不能超过100℃,同时温度过高会发生副反应,给液体加热时加入沸石的作用是防止液体瀑沸;
(3)减少生成物能促进平衡向正反应方向移动;
(4)温度低于苯甲酸乙酯的沸点时,苯甲酸乙酯不被蒸馏出,要使苯甲酸乙酯不被蒸馏出,则温度应低于苯甲酸乙酯的沸点,所以温度应低于212.6℃,但要使乙醇和环己烷蒸馏出,所以温度应高于乙醇和环己烷的沸点;
(5)根据分流漏斗的使用方法可知,下层液体从下口放出,上层液体从上层倒出,苯甲酸乙酯的密度大小于水,据此判断,加入Na2CO3能与未反应的苯甲酸和硫酸,可以除去未反应的苯甲酸和硫酸,白烟是固体小颗粒,因为苯甲酸在100℃会迅速升华,所以可能是苯甲酸乙酯中混有未除净的苯甲酸,乙醇能与氯化钙形成沉淀CaCl2•6C2H5OH,所以可以除去乙醇,据此分析解答;
(6)实验的产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)根据装置图可知仪器A的名称为三颈烧瓶,加入三颈烧瓶中液体的体积大约为60mL,而烧瓶所能盛放溶液的体积不超过烧瓶体积的 $\frac{2}{3}$,所以要选100mL规格R的三颈烧瓶,故选C,
故答案为:三颈烧瓶;C;
(2)苯甲酸在100℃会迅速升华,所以制备苯甲酸乙酯时,温度不能超过100℃,同时温度过高会发生副反应,所以最合适的加热方法是水浴加热,加入沸石的作用是给液体加热时加入沸石的作用是防止液体瀑沸,
故答案为:水浴加热;防止副反应的发生和苯甲酸升华;防暴沸;
(3)反应 为可逆反应,生成物中有水生成,步骤①中使用分水器不断分离除去水,可以使生成物的浓度减小,化学平衡向着正向移动,从而增大了产率,
为可逆反应,生成物中有水生成,步骤①中使用分水器不断分离除去水,可以使生成物的浓度减小,化学平衡向着正向移动,从而增大了产率,
故答案为:使平衡不断地向正向移动;
(4)温度低于苯甲酸乙酯的沸点时,苯甲酸乙酯不被蒸馏出,要使苯甲酸乙酯不被蒸馏出,则温度应低于苯甲酸乙酯的沸点,所以温度应低于212.6℃,但要使乙醇和环己烷蒸馏出,所以温度应高于乙醇和环己烷的沸点即80.8℃,故选C;
(5)根据分流漏斗的使用方法可知,下层液体从下口放出,上层液体从上层倒出,苯甲酸乙酯的密度大小于水,所以有机层从下口放出,加入Na2CO3能与未反应的苯甲酸和硫酸,可以除去未反应的苯甲酸和硫酸,白烟是固体小颗粒,因为苯甲酸在100℃会迅速升华,所以可能是苯甲酸乙酯中混有未除净的苯甲酸,乙醇能与氯化钙形成沉淀CaCl2•6C2H5OH,所以可以除去乙醇,所以加入氯化钙的目的是除去乙醇,
故答案为:下口;除去硫酸和未反应的苯甲酸;苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华; 使产品中混有的 乙醇形成难溶于水的CaCl2•6C2H5OH,过滤除去;
(6)12.20g苯甲酸的物质的量为:$\frac{12.20g}{122g/mol}$=0.1mol,理论生成的苯甲酸乙酯的质量为0.1×150g=15g,而实际生成苯甲酸乙酯的质量为:12.86mL×1.05g•ml-1=13.503g,所以实验的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{13.503}{15}$×100%=90.02%,
故答案为:90.02%.
点评 本题考查了物质制备方案的设计,题目难度中等,明确制备原理为解答关键,试题涉及酯化反应原理、化学实验基本操作方法、产率的计算、化学平衡的影响因素等知识,注意掌握物质制备方案的设计及评价原则,试题充分考查了学生的分析能力及灵活应用基础知识的能力


科目:高中化学 来源: 题型:解答题
 X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题:
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题: ,其第一电离能在同周期元素中由大到小排第4 位.
,其第一电离能在同周期元素中由大到小排第4 位.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 今年5月18日桐庐县320国道化学品运输车侧翻造成1,1,2,2-四氯乙烷泄漏,该有机物是一种重要的有机溶剂,不溶于水且密度比水小 | |
| C. | 如图所示的有机物分子式为C14H12O2,此有机物能与NaHCO3溶液反应放出CO2气体 | |
| D. | 化合物 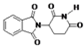 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com