

���� ֱ���������Ʊ��������ۺ��������������������ܽ��������У�����PHֵ����˫��ˮ���������������������ӣ��پ�ˮ��þۺ�������������Ũ������ɵþۺ���������
��1��Fe2+��ˮ�⣬����������Է�ֹˮ�⣮ȡ������Fe2+Ũ�ȣ��Ƕ�����������Ŀ����ȷ������Fe2+����H2O2������
��2��pH��ֽ�IJ��������ǽ�СƬpH��ֽ���ڵ�ΰ壨��������ϣ��ò�����մȡ��������Һ������ֽ�ϣ�Ѹ�������ɫ�����գ�����Һ��pHƫС��˵��Fe2+�в���ˮ���ˣ������¾ۺ���������������������ƫ�ͣ�
��3��ˮ���ԭ����Fe2+���ˮ�е�OH-��
��4���ٷ�̪�����죬�ʴﵽ�ζ��յ������Ϊ�������һ��NaOH��Һ���ձ���Һ����ɫǡ��Ϊdz��ɫ����30s�ڲ���ɫ��
����֪���λ���=$\frac{n��OH{\;}^{-}��}{3n��Fe��}$��100%��ʽ��n��OH-����n��Fe���ֱ��ʾPFS��OH-��Fe3+�����ʵ�����ͨ����ѧʽ���㣮
��� �⣺��1��Fe2+��ˮ�⣬ʵ���������������Ƿ�ֹ��������ˮ�⣬ȡ������Fe2+Ũ�ȣ��Ƕ�����������Ŀ����ȷ������Fe2+����H2O2������
�ʴ�Ϊ������Fe2+ˮ�⣻ȷ������Fe2+����H2O2������
��2������pH��ֽ�IJ���������������СƬpH��ֽ���ڵ�ΰ壨��������ϣ��ò�����մȡ��������Һ������ֽ�ϣ�Ѹ�������ɫ�����գ�����Һ��pHƫС��˵��Fe2+�в���ˮ���ˣ������¾ۺ���������������������ƫ�ͣ�
�ʴ�Ϊ����СƬpH��ֽ���ڵ�ΰ壨��������ϣ��ò�����մȡ��������Һ������ֽ�ϣ�Ѹ�������ɫ�����գ� ƫ�ͣ�
��3��ˮ���ԭ����Fe2+���ˮ�е�OH-����Ӧ�ķ���ʽΪ��4Fe2��SO4��3+4nH2O?4Fe2��OH��n��SO4�� 3-n/2+2nH2SO4��
�ʴ�Ϊ��4Fe2��SO4��3+4nH2O?4Fe2��OH��n��SO4�� 3-n/2+2nH2SO4��
��4���ٷ�̪�����죬�ʴﵽ�ζ��յ������Ϊ���������һ��NaOH��Һ���ձ���Һ����ɫǡ��Ϊdz��ɫ����30s�ڲ���ɫ��
�ʴ�Ϊ���������һ��NaOH��Һ���ձ���Һ����ɫǡ��Ϊdz��ɫ����30s�ڲ���ɫ��
����֪���λ���=$\frac{n��OH{\;}^{-}��}{3n��Fe��}$��100%��ʽ��n��OH-����n��Fe���ֱ��ʾPFS��OH-��Fe3+�����ʵ�����ͨ����ѧʽ�ļ��㣬w=$\frac{��{V}_{0}-V��c��10{\;}^{-3}}{3��\frac{mW{\;}_{1}}{56}}$��100%=$\frac{56��V{\;}_{0}-V��c��10{\;}^{-3}}{3mW{\;}_{1}}$��100%��
�ʴ�Ϊ��$\frac{56��V{\;}_{0}-V��c��10{\;}^{-3}}{3mW{\;}_{1}}$��100%��
���� ���⿼�������ˮ�⡢pH��ֽ��ʹ�á�����ʽ����д�����ʵ�������ؼ��㣬��Ҫ�����̷����жϣ��������ʵ�����Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����-OH
����-OH ����-COOH--
����-COOH-- ȩ��
ȩ��

 ����
����
| A�� | ��1����2����3����4����5�� | B�� | ��2����4�� | C�� | ��2����3����4�� | D�� | ��2����4����5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
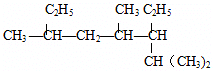 ���ƣ�2��4��6-����-3-�һ�����
���ƣ�2��4��6-����-3-�һ����� 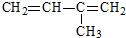 ���ƣ�2-��-1��3-����ϩ
���ƣ�2-��-1��3-����ϩ
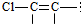 �ṹ����4��
�ṹ����4��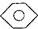 ��
��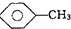 ��KMnO4��H+����Һ��
��KMnO4��H+����Һ��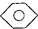 ��
��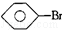 ��C6H12����ϩ������ˮ��
��C6H12����ϩ������ˮ��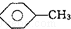 ��CCl4���Ҵ���ˮ��
��CCl4���Ҵ���ˮ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
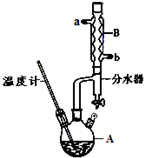 ������������C9H10O2����һ����ɫ��Һ�壬������ˮ������ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��壬�ܼ��ȣ�
������������C9H10O2����һ����ɫ��Һ�壬������ˮ������ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��壬�ܼ��ȣ�
| ���� | ��Է������� | ��ɫ��״̬ | �е㣨�棩 | �ܶȣ�g•cm-3�� |
| ������ | 122 | ��ɫƬ״���� | 249 | 1.2659 |
| ���������� | 150 | ��ɫ����Һ�� | 212.6 | 1.05 |
| �Ҵ� | 46 | ��ɫ����Һ�� | 78.3 | 0.7893 |
| ������ | 84 | ��ɫ����Һ�� | 80.8 | 0.7318 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
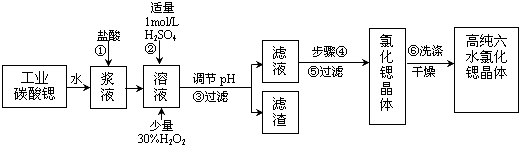
| �������� | Fe��OH��3 | Fe��OH��2 |
| ��ʼ������pH | 1.5 | 6.5 |
| ������ȫ��pH | 3.7 | 9.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ������� | �� | �� | �� | ������ | �⻯�� |
| ��ѧʽ | ��H2SO4 ��HNO3 | ��NaOH ��KOH | ��Na2SO4 ��K2SO4��KNO3 | ��SO2 ��SO3 | ��NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
 ��ͼ��ʾ����ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵������ȷ���ǣ�������
��ͼ��ʾ����ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵������ȷ���ǣ�������| A�� | Na2O2������������Ŀ֮��Ϊ1��2 | |
| B�� | ��Ӧ�ٵ����ӷ���ʽΪ��Na+2H2O�TNa++2OH-+H2�� | |
| C�� | ��Ӧ������ܲ���0.05 mol O2 | |
| D�� | �١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С���٣��ڣ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com