
分析 设盐酸的浓度为xmol/L.由于是用酚酞做指示剂,故当溶液的pH=8时变色,即当溶液显弱碱性即溶液中c(OH-)=10-6mol/L时变色.根据氢氧化钠的稍过量并结合c(OH-)=10-6mol/L,列式计算即可求得盐酸的浓度.
解答 解:设盐酸的浓度为xmol/L.由于是用酚酞做指示剂,故当溶液的pH=8时变色,即当溶液显弱碱性即溶液中c(OH-)=10-6mol/L时变色,由此可知,氢氧化钠稍过量.
故有:
c(OH-)=10-6mol/L=$\frac{0.1023mol/L×25.70mL×1{0}^{-3}-xmol/L×25.00mL×1{0}^{-3}}{(25.70mL+25.00mL)×1{0}^{-3}}$,求得盐酸的浓度x=0.1051mol/L.
答:盐酸溶液的浓度为0.1051mol/L.
点评 本题考查了酸碱中和滴定中的有关计算,应注意的是用不同的指示剂所带来的计算方法的不同.


科目:高中化学 来源: 题型:选择题
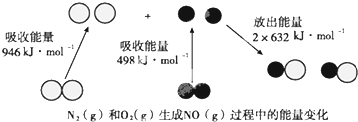
| A. | N≡N键的键能为946kJ•mol-1 | |
| B. | N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| C. | 当有16gO2(g)参加反应时,该反应吸收90kJ热量 | |
| D. | 当有1mol电子发生转移时,该反应吸收90kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
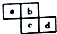
| A. | 原子半径:c>d>a>b | |
| B. | 原子序数d可能是a的3倍 | |
| C. | 最高价含氧酸的酸性c可能比d强 | |
| D. | 四种元素的氢化物可能是18电子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4g D2和足量O2反应可生成D2O 2NA个 | |
| B. | 98g H3PO4和H2SO4的混合物中含氢原子2.5NA个 | |
| C. | 6.02×1023个葡萄糖分子约含羟基6NA个 | |
| D. | 1molNa完全燃烧可转移电子NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com