
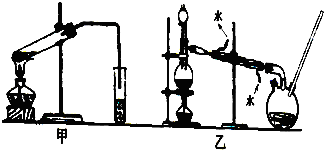
分析 (1)银镜反应的条件是在碱性条件下发生;
(2)能发生银镜反应的物质必含有醛基官能团,甲酸含有醛基,可以发生银镜反应;
(3)依据银镜反应的实验操作和注意问题分析判断;
(4)依据实验装置,实验过程,反应的原理产物性质分析;
(5)依据酯化反应的反应历程是羧酸脱羟基醇脱氢书写;
(6)根据甲醇性质分析,甲醇是有毒的易挥发的有机物;
(7)根据甲酸、甲醇的性质和饱和碳酸钠的作用解答;
(8)根据酯在碱溶液中水解生成酸盐和醇分析判断.
解答 解:(1)银镜反应的条件是在碱性条件下发生,在甲酸进行银镜反应前,必须在其中加入一定量的碱,可以加NaOH溶液,
故答案为:NaOH溶液;反应必须在碱性条件下发生;
(2)甲酸含有醛基,能发生银镜反应,发生反应HCOOH+2Ag(NH3)2OH $\stackrel{△}{→}$(NH4)2CO3+2Ag↓+2NH3↑+H2O,
故答案为:HCOOH+2Ag(NH3)2OH $\stackrel{△}{→}$(NH4)2CO3+2Ag↓+2NH3↑+H2O;
(3)银镜反应的条件是在碱性条件下发生的,是在新制的银氨溶液中加入少量需要检验的有机物,水浴加热,生成银镜现象,反应过程中不能震荡,试管要洁净,银氨溶液需要新制,制备方法是想硝酸银溶液中加入氨水,生成沉淀,继续加入到沉淀恰好溶解得到银氨溶液,所以成功的做了银镜反应,
A、用洁净试管使银析出均匀,故A需要;
B、在浓度为2%的NH3•H2O中滴入稍过量的浓度为2%的硝酸银,滴加试剂顺序错误,需碱过量,故B不需要;
C、久置的银氨溶液会析出氮化银、亚氨基化银等爆炸性沉淀物,易反应危险.故C不需要;
D、为得到均匀的银镜,需要用水浴加热,故D不需要;
故答案为:BCD;
(4)乙装置中长导管A的作用是冷凝回流甲醇,平衡内外大气压强,
故答案为:冷凝回流甲醇,平衡内外大气压强;
(5)甲酸和甲醇进行酯化反应的历程是羧酸脱羟基醇脱氢,反应化学方程式为:HCOOH+CH318OH$?_{△}^{浓H_{2}SO_{4}}$HCO18OCH3+H2O,
故答案为:HCOOH+CH318OH$?_{△}^{浓H_{2}SO_{4}}$HCO18OCH3+H2O;
(6)甲醇是有毒的易挥发的有机物,需要密封装置中进行,所以选择乙,冷凝效果好,减少了甲醇等有毒物质对大气的污染,
故答案为:乙;冷凝效果好,减少了甲醇等有毒物质对大气的污染;
(7)甲酸和甲醇沸点低,易挥发,需用碎瓷片(沸石),为了降低了甲酸甲酯的溶解度,同时还能除去混有的甲醇和甲酸,需用饱和碳酸钠溶液,
故答案为:饱和碳酸钠溶液;碎瓷片(沸石);
(8)用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,是因为甲酸甲酯在NaOH溶液中发生水解,生成甲酸钠和甲醇,得不到酯,
故答案为:NaOH溶液的碱性较强,甲酸甲酯在NaOH溶液中发生水解.
点评 本题考查了有机物性质的应用、实验操作的步骤、注意问题、试剂选择、反应现象、装置的分析等,掌握醛基检验的实验方法判断,装置的原理应用是解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②HNO3 | ③NaOH ④KOH | ⑤Na2SO4 ⑥K2SO4,KNO3 | ⑦SO2 ⑧SO3 | ⑨NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷 | B. | 3-甲基-1-丁炔 | ||
| C. | 3-甲基-2-戊烯 | D. | 3,3-二甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )| A. | Na2O2中阴阳离子数目之比为1:2 | |
| B. | 反应①的离子方程式为:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 反应③最多能产生0.05 mol O2 | |
| D. | ①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com