
分析 (1)根据N元素守恒,可知n(NO2)+n(NO)=n硝酸溶液(HNO3)-n反应后溶液(NO3-),令NO2、NO的物质的量分别为xmol、ymol,利用电子转移守恒、二者的物质的量之和列方程计算.
(2)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO),根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3),再根据V=$\frac{n}{c}$计算.
解答 解:(1)6.4g Cu的物质的量=$\frac{6.4g}{64g/mol}$=0.1mol,所以溶液n(Cu2+)=n(Cu)=0.1mol,根据N元素守恒,可知n(NO2)+n(NO)=n硝酸溶液(HNO3)-n反应后溶液(NO3-)=0.05L×9mol/L=0.45mol-0.1L×3mol/L=0.15mol,
令NO2、NO的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.15}\\{x+y=0.15\\;x+3y=0.1×2}\end{array}\right.$,
解得x=0.125,y=0.025.
故答案为:0.125;
(2)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO)=0.15mol,根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3)=0.15mol,NaOH溶液的体积为$\frac{0.15mol}{1mol/L}$=0.15L=150mL.
故答案为:150.
点评 本题考查了氧化还原反应的有关计算,根据原子守恒、电荷守恒来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 4g D2和足量O2反应可生成D2O 2NA个 | |
| B. | 98g H3PO4和H2SO4的混合物中含氢原子2.5NA个 | |
| C. | 6.02×1023个葡萄糖分子约含羟基6NA个 | |
| D. | 1molNa完全燃烧可转移电子NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
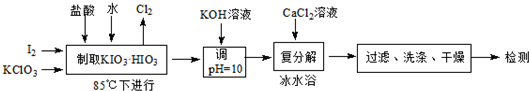
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定时的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由此可确定碘元素的相对原子质量为131 | |
| B. | $\stackrel{131}{53}$I是碘元素的一种同位素 | |
| C. | $\stackrel{131}{53}$I核素中含中子数为53 | |
| D. | $\stackrel{131}{53}$I2的摩尔质量为262 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
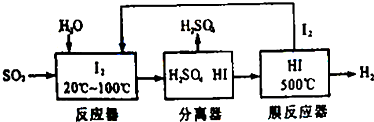
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
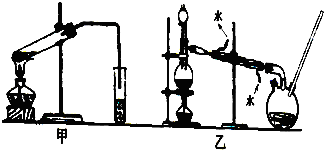
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2 mol/(L•min) | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应放热反应 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 曲线Ⅱ对应的条件改变是加入催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com