
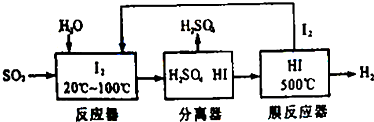
分析 (1)根据题目所给物质的量的多少结合热化学方程式的书写方法来回答,反应的化学方程式为:4FeS2+11O2=2Fe2O3+8SO2,标出各物质的聚集状态;在反应中4 mol FeS2的质量为m(FeS2)=4 mol×120 g•mol-1=480 g,放热Q=480 g×7.1 kJ/g=3408 kJ,标注物质聚集状态和对应反应的焓变写出;
(2)根据该循环的工艺流程是用硫铁矿(FeS2)燃烧产生的SO2来制硫酸,在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI?I2+H2,将两个方程式相加得;
(3)根据平衡移动的原理来分析,将H2分离出来有利于平衡向右移动,利于I2和H2的生成;
(4)①负极反应物MH失去电子,生成的H+在碱性条件下生成H2O;
②阴极上是氧气发生的电子的过程,碱性条件下生成氢氧根离子.
解答 解:(1)反应的化学方程式为:4FeS2+11O2=2Fe2O3+8SO2,在反应中4 mol FeS2的质量为m(FeS2)=4 mol×120 g•mol-1=480 g,放热Q=480 g×7.1 kJ/g=3408 kJ,对应的热化学方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ•mol-1,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ•mol-1;
(2)在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI?I2+H2,将两个方程式相加得:SO2+2H2O=H2SO4+H2,
故答案为:SO2+2H2O=H2SO4+H2;
(3)在膜分离器中发生反应:2HI?I2+H2,将H2分离出来有利于平衡向右移动,利于I2和H2的生成,故答案为:有利于平衡向右移动,有利于碘和氢气的生成;
(4)①负极反应物MH失去电子,生成的H+在碱性条件下生成H2O,电解反应式为:MH-e-+OH-=H2O+M,故答案为:MH-e-+OH-=H2O+M;
②阴极上是氧气发生的电子的过程,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-.
点评 本题综合考查物质的制备、分离以及元素化合物知识的综合理解和运用,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握物质的性质以及原电池、电解池的原理,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
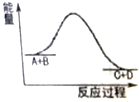
| A. | 该反应为吸热反应 | |
| B. | 该反应只有在加热的条件下才能进行 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应物中的化学键断裂要放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力是普遍存在的一种分子间作用力,属于电性作用 | |
| B. | 范德华力比较弱,但范德华力越强,物质的熔点和沸点越高 | |
| C. | 氢键属于一种较强的分子间作用力,只能存在于分子之间 | |
| D. | 形成氢键时必须含有氢原子,另外氢原子两边的原子必须具有很强的电负性、很小的原子半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com