
| A. | 范德华力是普遍存在的一种分子间作用力,属于电性作用 | |
| B. | 范德华力比较弱,但范德华力越强,物质的熔点和沸点越高 | |
| C. | 氢键属于一种较强的分子间作用力,只能存在于分子之间 | |
| D. | 形成氢键时必须含有氢原子,另外氢原子两边的原子必须具有很强的电负性、很小的原子半径 |
科目:高中化学 来源: 题型:解答题
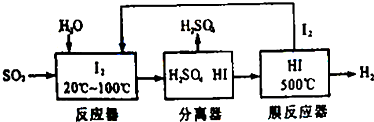
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 乙酸 | 乙醇 | |
| 熔点/℃ | 16.6 | -114.3 |
| 沸点/℃ | 117.9 | 78.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2 mol/(L•min) | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应放热反应 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 曲线Ⅱ对应的条件改变是加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27g,第二次称量沉淀质量为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe | B. | Cu | C. | Fe 和 Cu | D. | Cu 和 Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
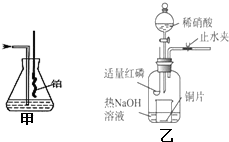 Ⅰ、实验室模拟氨催化氧化的装置如图甲:
Ⅰ、实验室模拟氨催化氧化的装置如图甲:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com