
分析 质子数相同质量数(或中子数)不同的原子互称同位素;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
同种元素形成的不同单质互为同素异形体;
具有相同分子式而结构不同的化合物互为同分异构体.
解答 解:①金刚石与“足球烯”C60是同种元素形成的不同单质,故互为同素异形体;
②D与T是氢元素的不同氢原子,互为同位素;
③16O、17O和18O是氧元素的不同氢原子,互为同位素;
④氧气(O2)与臭氧(O3)是同种元素形成的不同单质,故互为同素异形体;
⑤CH4和CH3CH2CH3的通式相同,结构相似,相差2个CH2原子团,互为同系物;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)的分子式相同而结构不同,故互为同分异构体;
⑦正丁烷和异丁烷的分子式相同而结构不同,故互为同分异构体;
⑧甲醇和乙醇的通式相同,结构相似,相差2个CH2原子团,互为同系物;
故答案为:②③; ⑤⑧;①④;⑥⑦.
点评 本题考查“四同”比较,难度不大,侧重考查学生的辨别能力,根据概念逐项判断即可.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6g、0.1mol | B. | 4.6g、0.2mol | C. | 0.3g、0.2mol | D. | 5.0g、0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
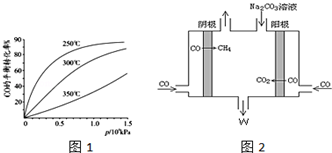
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
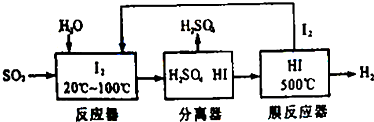
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过年时尽量少燃放烟花爆竹 | |
| B. | PM2.5是形成沙尘暴天气的主要因素 | |
| C. | 其颗粒小,在大气中的停留时间长、输送距离远,因而对人体健康影响更大 | |
| D. | 香烟烟雾颗粒的直径大多在0.1至1.0微米,所以公共场所禁烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27g,第二次称量沉淀质量为2.33g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com