



分析 (1)纯水中c(H3O+)=c(OH-),K2=$\frac{c({H}_{3}{O}^{+}).c({O}^{2-})}{c(O{H}^{-})}$,则c(O2-)=$\frac{{K}_{2}.c(O{H}^{-})}{c({H}_{3}{O}^{+})}$=K2;
(2)催化剂在反应前后催化剂的质量、化学性质均不变,碘受热易升华;
(3)带结晶水的硝酸铁、硝酸铜溶于水,然后向溶液中加入KOH并调节溶液的pH=4,生成Fe(OH)3、Cu(OH)2沉淀,过滤将沉淀洗涤、干燥然后煅烧得到CuFe2O4;
①硝酸铁在水溶液中发生微弱水解生成氢氧化铁;
②依据溶度积常数计算氢氧化铁、氢氧化铜沉淀完全的溶液pH;
③流程中是过滤得到的滤渣经过洗涤干燥进行灼烧;
④氧缺位体与水反应生成氢和铁酸铜(CuFe2O4),依据原子守恒书写配平;
⑤将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,CuFe2O4-a的质量为CuFe2O4的96.6%,据此列式计算.
解答 解:(1)水中c(H3O+)=c(OH-),K2=$\frac{c({H}_{3}{O}^{+}).c({O}^{2-})}{c(O{H}^{-})}$,c(O2-)=$\frac{{K}_{2}.c(O{H}^{-})}{c({H}_{3}{O}^{+})}$=K2=1.0×10-36mol•L-1,故答案为:1.0×10-36;
(2)少量铝粉和碘反应后生成物只有碘化铝,说明水没有参加反应,但是没有加入水之前,铝粉和碘没有什么变化,加入水之后,反应放出的热量使碘升华成紫色碘蒸气,碘受热易升华,说明反应是放热反应,反应后生成物只有碘化铝白色固体,说明水改变了该反应的速率,则水是一种催化剂;
故选C、D;
(3)①搅拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2,铁离子水解生成氢氧化铁,所以铁元素的存在形式为Fe3+和Fe(OH)3,
故答案为:Fe(OH)3;
②搅拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2的物质的量浓度分别为2.6mol•L-1、1.3mol•L-1,沉淀完全的离子浓度小于10-5mol/L
已知:Ksp[Fe(OH)3]=2.6×10-39,c(OH-)=$\root{3}{\frac{2.6×1{0}^{-39}}{1{0}^{-5}}}$=6.4×10-12mol/L,c(H+)=1.6×10-3mol/L,PH=3-lg1.6≈2.8,图象中铁离子沉淀完全的pH错误;
Ksp[Cu(OH)2]=2.2×10-20,溶液中氢氧根离子浓度c(OH-)=$\sqrt{\frac{2.2×1{0}^{-20}}{1{0}^{-5}}}$=4.7×10-8mol/L,c(H+)=$\frac{1{0}^{-14}}{4.7×1{0}^{-8}}$=2.1×10-7mol/L,溶液的pH≈6.7,图象B符合,
故答案为:B;
③流程中是过滤得到的滤渣经过洗涤干燥进行灼烧,操作Ⅲ为洗涤、干燥,
故答案为:洗涤;干燥;
④氧缺位体与水反应制氢的化学方程式为CuFe2O4-a+aH2O=CuFe2O4+aH2↑,
故答案为:CuFe2O4-a+aH2O=CuFe2O4+aH2↑;
⑤将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,CuFe2O4-a的质量为CuFe2O4的96.6%,则$\frac{M(CuF{e}_{2}{O}_{4-a})}{M(CuF{e}_{2}{O}_{4})}$×100%=96.6%,
解得:a=0.51,
故答案为:0.51.
点评 本题考查较为综合,涉及物质分离提纯的方法分析、溶度积常数的计算分析判断、弱电解质电离分析应用,题目难度中等,注意反应过程中原子守恒的理解应用,掌握基础是关键,试题培养了学生的分析、理解能力及灵活应用能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
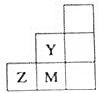
| A. | 非金属性:Y>Z>M | |
| B. | 离子半径:M->Z2->Y- | |
| C. | Z元素存在同素异形现象 | |
| D. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
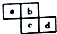
| A. | 原子半径:c>d>a>b | |
| B. | 原子序数d可能是a的3倍 | |
| C. | 最高价含氧酸的酸性c可能比d强 | |
| D. | 四种元素的氢化物可能是18电子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
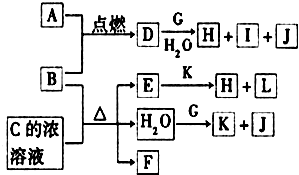 图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.
图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com