
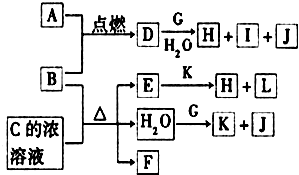
 图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.
图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.分析 金属B在A气体中燃烧产生棕黄色烟得到D,B与C溶液反应E的稀溶液为蓝色,E中含有Cu2+,则B为Cu,A为Cl2,D为FeCl2,F为无色、有刺激性气味气体,且能使品红溶液褪色,则F为SO2,可推知C为H2SO4,E为CuSO4.J的元素原子核内只有一个质子,则J为H2;I的焰色反应为黄色,所以I含Na元素,由D+G+H2O→H+I+J,可知金属G为Na,H为Cu(OH)2,I为NaCl,由H2O+G→K+J(H2),可知K为NaOH,L为Na2SO4,据此解答.
解答 解:金属B在A气体中燃烧产生棕黄色烟得到D,B与C溶液反应E的稀溶液为蓝色,E中含有Cu2+,则B为Cu,A为Cl2,D为CuCl2,F为无色、有刺激性气味气体,且能使品红溶液褪色,则F为SO2,可推知C为H2SO4,E为CuSO4.J的元素原子核内只有一个质子,则J为H2;I的焰色反应为黄色,所以I含Na元素,由D+G+H2O→H+I+J,可知金属G为Na,H为Cu(OH)2,I为NaCl,由H2O+G→K+J(H2),可知K为NaOH,L为Na2SO4.
(1)框图中所列物质中属于非电解质的物质是:SO2,故答案为:SO2;
(2)将CuCl2的水溶液蒸干,促进铜离子彻底水解得到氢氧化铜,灼烧时氢氧化铜分解,得到的固体物质的化学式为CuO,故答案为:CuO;
(3)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,由电荷守恒可知:则溶液中c(Na+)+c(NH4+)+c(H+)=c(NO3-)+c(OH-),所得溶液的pH=7,则c(Na+)+c(NH4+)+=c(NO3-),故c(Na+)<=c(NO3-),
故答案为:<;
(4)①4g 氢气在纯氧中完全燃烧生成液态化合物,放出热量为Q kJ,则1mol氢气燃烧放出的热量为0.5 Q kJ/mol,表示氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-0.5Q kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-0.5Q kJ/mol;
②工业上通常电解饱和氯化钠溶液等制取氯气,反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(5)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4:3,则M为S2O32-,由反应现象可知,氯气与M的离子反应为:Cl2+S2O32-+H2O═2Cl-+2H++S↓+SO42-,
故答案为:Cl2+S2O32-+H2O═2Cl-+2H++S↓+SO42-;
(6)25℃时,若K sp[Cu(OH)2]=2.2×10-20,向0.022mol/L的CuSO4溶液中逐滴滴入溶液NaOH(假定溶液总体积不变),当开始出现沉淀时,溶液中的c(OH-)=$\sqrt{\frac{2.2×10{\;}^{-20}}{0.022}}$mol/L=10-9mol/L,
故答案为:1×10-9mol/L.
点评 本题考查无机物的推断,物质的性质及反应现象为推断突破口,题目涉及物质种类多、知识点多,关键是熟练掌握元素化合物知识,难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②HNO3 | ③NaOH ④KOH | ⑤Na2SO4 ⑥K2SO4,KNO3 | ⑦SO2 ⑧SO3 | ⑨NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷 | B. | 3-甲基-1-丁炔 | ||
| C. | 3-甲基-2-戊烯 | D. | 3,3-二甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 反应 | 化学平衡常数 |
| 1 | Au+6HNO3(浓)?Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-=AuCl4- | >>1 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )| A. | Na2O2中阴阳离子数目之比为1:2 | |
| B. | 反应①的离子方程式为:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 反应③最多能产生0.05 mol O2 | |
| D. | ①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3OOCCH3甲酸乙酯 | ||
| C. | 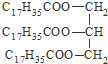 硬脂酸甘油脂 硬脂酸甘油脂 | D. | 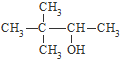 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与氯气反应制氯化铁,推出铁与碘反应制碘化铁 | |
| B. | CO2通入到漂白粉溶液中发生CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推出SO2通入到漂白粉溶液中发生SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO | |
| C. | Na2O2与CO2反应生成Na2CO3和O2,推出Na2O2与SO2反应可生成Na2SO3和O2 | |
| D. | 利用可溶性的铝盐溶液与氨水反应制Al(OH)3,推出可溶性的铁盐溶液与氨水反应制Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com