
【题目】下列有机化合物中同分异构体数目最多的是( )
A.C8H10(芳香烃)B.C5H10O2(酸)C.C4H8Cl2D.C4H8O2(酯)
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)俗称双氧水。是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业。回答下列问题:
(1) H2O2的电子式为_______________。
(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜。
已知:Cu(s)+2H+ (aq)==Cu2+(aq) + H2(g) H= +64 kJ/mol
2H2O2(1) ==2H2O(l)+O2(g) H =-196 kJmol
H2(g) + l/2O2(g) ==H2O(l) H =-286 kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:__________________。
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4![]() (NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
(NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
①电解时阳极的电极反应式为___________________;
②(NH4)2 S2O8水解时发生反应的化学方程式为 ____________________。
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验I | 25℃ | 三氧化二铁 | 10mL 5% H2O2 |
甲组实验II | 25℃ | 二氧化锰 | 10 mL 5% H2O2 |
甲、乙两小组得出如下图数据。
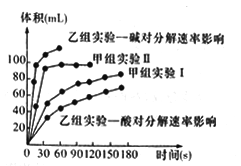
①甲小组实验得出的结论是______________________。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在________(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为_______________;支持这一方案的理由是_______________________。
③已知过氧化氢还是一种极弱的二元酸:H2O2![]() H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-
H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-![]() HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。
HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
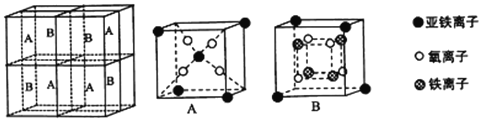
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:

(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。

(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。
(4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。
(5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。
(6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定:
① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。
④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960gmol-1,计算过程中不考虑固体损失和气体溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度均为4.0 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的锌粉,充分反应后生成气体体积比为2∶3,则加入锌粉的质量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对SO2和SO3的叙述正确的是 ( )
A. 通常条件下,SO2是无色、无味的气体,易溶于水
B. 都是酸性氧化物,其水溶液都是强酸
C. 都可使品红溶液褪色,加热时红色又能再现
D. 都能跟碱液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com