

 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。| A.容器内N2、H2、NH3的浓度之比为l:3:2 |
B. |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
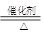 4NO+6H2O (2分)减小(2分)(2)-1210.9 kJ/mol(2分)
4NO+6H2O (2分)减小(2分)(2)-1210.9 kJ/mol(2分)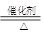 4NO+6H2O,由于事成氨反应是放热反应,温度升高平衡向逆反应方向进行,平衡常数值减小。
4NO+6H2O,由于事成氨反应是放热反应,温度升高平衡向逆反应方向进行,平衡常数值减小。

科目:高中化学 来源:不详 题型:单选题
| A.通常状况下,氨的溶解度不大 | B.氨水中的NH3·H2O电离出少量的OH- |
| C.溶于水的氨分子只有少量电离 | D.氨本身的碱性弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
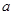 L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用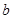 mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗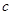 molBaCl2,则原溶液中
molBaCl2,则原溶液中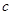 (NO
(NO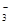 )为( )
)为( )A.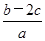 mol·L-1 mol·L-1 | B.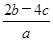 mol·1-1 mol·1-1 |
C. mol·L-1 mol·L-1 | D.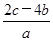 mol·L-1 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有Fe3+ | B.只有Fe2+ | C.有Fe2+和Fe3+ | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com