
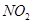 ,稀硝酸一般生成
,稀硝酸一般生成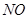 ,100 mL 2 mol/L的稀硝酸中硝酸的物质的量为0.1ⅹ2="0.2" mol,1.92 g铜的物质的量为1.92/64="0.03" mol根据反应方程式计算如下:
,100 mL 2 mol/L的稀硝酸中硝酸的物质的量为0.1ⅹ2="0.2" mol,1.92 g铜的物质的量为1.92/64="0.03" mol根据反应方程式计算如下: 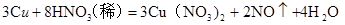
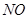 的物质的量为0.02 mol ,标准状况下的体积为0.02ⅹ22.4=0.448L,反应过程中硝酸中的氮元素从+5价降低到一氧化氮中的+2价,降低3个所以转移的电子用
的物质的量为0.02 mol ,标准状况下的体积为0.02ⅹ22.4=0.448L,反应过程中硝酸中的氮元素从+5价降低到一氧化氮中的+2价,降低3个所以转移的电子用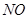 的量进行计算为
的量进行计算为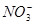 的物质的量为0.2-0.02=0.18mol,所以
的物质的量为0.2-0.02=0.18mol,所以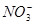 的物质的量浓度为0.18/0.1="1.8" mol/L.
的物质的量浓度为0.18/0.1="1.8" mol/L.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.平面三角形,键角小于120° |
| B.平面三角形,键角为120° |
| C.三角锥形,键角小于109°28′ |
| D.三角锥形,键角为109°28′ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.打开浓硝酸的瓶盖会冒白雾 | B.锌跟稀硝酸的反应是置换反应 |
| C.常用硝酸来制炸药、化肥等 | D.稀硝酸也是一种强氧化性酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。| A.容器内N2、H2、NH3的浓度之比为l:3:2 |
B. |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.1:2 | C.1:3 | D.3:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.28mol | B.0.31mol |
| C.(n + 0.2) mol | D.(n + 0.4) mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题




查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com