
【题目】第四周期的多数元素及其化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1) 基态Ti原子中,最高能层电子的电子云轮廓形状为___,与Ti同周期的所有过渡元素的基态原子中,写出任意一种最外层电子数与钛不同的元素外围电子排布式_____。
(2) 琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_________________。
(3) SCN— 可用于Fe3+的检验,写出与SCN— 互为等电子体的一种微粒:_____。
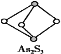
(4) 成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如图,As原子的杂化方式为______,雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式:__________________。SnCl4分子的立体构型为_______。
(5)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构,其晶胞结构(晶胞中相同位置的原子相同)如图所示(注意:D不在体心):
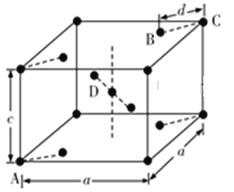
①4个微粒A、B、C、D中,属于氧原子的是________________。
②若A、B、C原子的坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D原子的坐标为D(0.19a,____, ____);若晶胞底面边长为x,则钛氧键的键长d=_______(用代数式表示)。
【答案】球形 3d54s1或3d104s1 Fe3+的3d5半满状态更稳定 N2O(或CO2、CS2、OCN-) sp3 2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑ 正四面体 B、D 0.81a 0.5c ![]()
【解析】
(1)基态Ti原子的核外电子排布式为[Ar]3d24s2,结合构造原理与洪特规则分析解答;
(2)根据洪特规则,处于半充满、全充满状态更稳定;
(3)根据原子总数相等、价电子总数也相等的微粒互为等电子体分析书写;
(4)由结构图可知,黑色球为As、白色球为S,分子中As原子形成3个σ键、还含有1对孤电子对,据此判断杂化类型;As2S3和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,据此书写并配平反应方程式;SnCl4分子中Sn原子形成4个Sn-Cl键,没有孤电子对,据此判断;
(5)①根据均摊法计算出处于不同位置的微粒数,结合化学式TiO2分析判断;②根据A、B、C的原子坐标,坐标系原点选取为A,根据立体几何知识分析D的原子坐标并计算钛氧键键长d。
(1)基态Ti原子的核外电子排布式为[Ar]3d24s2,最高能层电子为4s能级,电子云轮廓形状为球形;与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同,结合构造原理与洪特规则,符合条件的元素原子的价电子排布为3d54s1、3d104s1,故答案为:球形;3d54s1或3d104s1;
(2)Fe2+价电子为3d6,失去1个电子形成更稳定的3d5半满状态的Fe3+,导致Fe2+易被氧化成Fe3+,故答案为:Fe3+的3d5半满状态更稳定;
(3)C原子与1个单位负电荷可以等效替换为N原子,N原子与1个单位负电荷可以替换为O原子,S原子可以用氧原子替换,因此与SCN-互为等电子体的微粒为:N2O、CO2、CS2、OCN-,故答案为:N2O(或CO2、CS2、OCN-);
(4)由结构图可知,黑色球为As、白色球为S,分子中As原子形成3个σ键、还含有1个孤电子对,杂化轨道数目为3+1=4,As杂化方式为sp3杂化;As2S3和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,反应方程式为:2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑;SnCl4分子中Sn原子形成4个Sn-Cl键,没有孤电子对,价层电子对数为4,分子空间构型为正四面体形,故答案为:sp3;2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑;正四面体;
(5)①根据晶胞结构分析,四方晶胞中,顶点粒子占![]() ,面上粒子占
,面上粒子占![]() ,内部粒子为整个晶胞所有,所以一个晶胞中,顶点粒子(A、C)有8×
,内部粒子为整个晶胞所有,所以一个晶胞中,顶点粒子(A、C)有8×![]() =1个,面上粒子(B)有4×
=1个,面上粒子(B)有4×![]() =2个,内部粒子有3个,由于晶体的化学式为TiO2,所以4个微粒A、B、C、D中,属于氧原子的是:B、D,体心和顶点(A、C)为Ti原子,故答案为:B、D;
=2个,内部粒子有3个,由于晶体的化学式为TiO2,所以4个微粒A、B、C、D中,属于氧原子的是:B、D,体心和顶点(A、C)为Ti原子,故答案为:B、D;
②A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),坐标系原点选取点A,O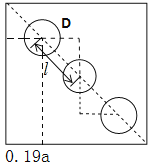 (俯视图),l即为钛氧键的键长d,根据几何知识,则D点的坐标为(0.19a,0.81a,0.5c),金红石晶胞中,Ti处于体心,体心Ti周围有6个O形成八面体结构,上底面结构为:
(俯视图),l即为钛氧键的键长d,根据几何知识,则D点的坐标为(0.19a,0.81a,0.5c),金红石晶胞中,Ti处于体心,体心Ti周围有6个O形成八面体结构,上底面结构为: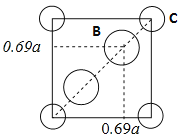 (俯视图),根据上底面结构,d=(a-0.69a)×
(俯视图),根据上底面结构,d=(a-0.69a)×![]() =0.31×
=0.31×![]() a,由于底边长为x,即x=a,所以d=0.31×
a,由于底边长为x,即x=a,所以d=0.31×![]() x,故答案为:0.81a; 0.5c; 0.31×
x,故答案为:0.81a; 0.5c; 0.31×![]() x。
x。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向25 mL 0.1 mol·L-1NaOH溶液中逐滴滴加0.2 mol·L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是
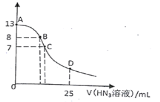
A. 0.1 mol·L-1 NaN3溶液pH约为8.85
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)<12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )
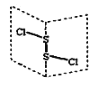
A. 第一电离能、电负性均是 Cl > S
B. S2Cl2为含有极性键和非极性键的极性分子
C. S2Br2与S2Cl2结构相似,由于S—Cl键键能更大,S2Cl2熔沸点更高
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达喜是常用的中和胃酸的药物,其有效成分是含结晶水的铝镁碱式盐。取该碱式盐6.02g,向其中逐滴加入4.00mol·L-1的盐酸,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时恰好反应完全。
(1)计算该碱式盐样品中碳酸根与氢氧根的物质的量之比:__。
(2)若达喜中镁、铝元素的物质的量之比为3:1,则氢元素的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按如下装置测定纯碱(含少量NaC1)的纯度。下列说法不正确的是
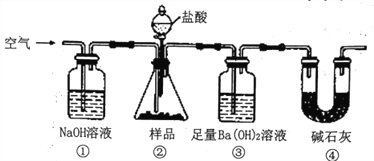
A. 滴入盐酸前,应将装置中含有CO2的空气排尽
B. 装置①、④的作用是防止空气中的CO2进入装置③
C. 必须在装置②、③间添加盛有饱和 NaHCO3溶液的洗气瓶
D. 反应结束时,应再通入空气将装置②中CO2转移到装置③中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
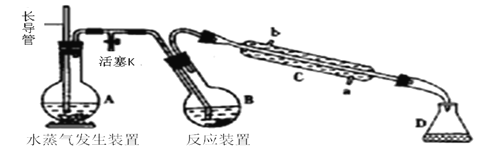
(1) 仪器C名称是___________,长导管作用是_____________________________。
(2)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏。若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(3)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是________。
(4)B中加入一定体积高氯酸和1.00g 氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a. 硫酸 b.硝酸 c.磷酸 d.乙酸 e.盐酸
②D中主要反应的离子方程式为_________________________________。
(5)向馏出液中加入25.00mL0.1000mol·L-1La(NO3)3溶液,得到LaF3沉淀(La3+不发生其他反应),再用0.1000 mol· L-1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1发生络合反应),消耗EDTA标准溶液平均19.80mL,则氟化稀土样品中氟的质量分数为______(百分数保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是 ( )

A. 根据图①溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量Cu,至pH在4左右。
B. 图②可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
C. 图③表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
D. 根据图④可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的化学平衡常数K随温度升高而变小
2AB3(g)的化学平衡常数K随温度升高而变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 A、B 置于固定容积为 1L 的密闭容器中,发生反应:3A(g)+B(g)2C(g)+2D(g),反应进行到 10 s 末,测得 A 的物质的量为 1.8 mol,B 的物质的量为 0.6 mol,C 的物质的量为 0.8 mol,下列说法错误的是( )
A.用 C 表示 10 s 内反应的平均反应速率为 0.8 molL-1s-1
B.反应前 A 的物质的量浓度是 3 molL-1
C.10 s 末,生成物 D 的物质的量为 0.8 mol
D.保持其他条件不变,适当升高温度,正逆反应速率都加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com