
【题目】将可能含有少量碳、硅杂质的a克镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。
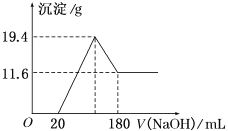
(1)原合金中Mg、Al的质量各是多少?
(2)盐酸的物质的量浓度是多少?
(3)取过滤后所得滤渣,向其中加入足量1mol/L NaOH溶液,可生成标准状况下0.112LH2,则a的最小值是多少?
【答案】(1)Mg:4.8g Al:2.7g
(2)8mol/L(3)7.57g
【解析】
试题分析:(1)根据图像可知,加入NaOH溶液0--20mL过程中并没有产生沉淀,这说明反应中盐酸剩余,加入的氢氧化钠与盐酸发生中和反应,则反应方程式为HCl + NaOH═NaCl+ H2O。继续加入氢氧化钠溶液开始出现沉淀,当沉淀达到最大值时,再加入氢氧化钠溶液沉淀开始减少,这说明此时氢氧化铝开始溶解在氢氧化钠溶液中,所以160—180mL过程中反应方程式为Al(OH)3 + NaOH ═NaAlO2 +2 H2O。
(2)溶解氢氧化铝消耗的氢氧化钠溶液体积是180ml—160ml=20ml,根据Al(OH)3+OH-=AlO2-+2H2O,所以铝离子的物质的量是5mol/L×0.02L=0.1mol,铝的质量是2.7g;根据方程式Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,生成氢氧化铝沉淀需要氢氧化钠溶液的体积是60ml,则与镁离子结合的氢氧化钠溶液的体积是160ml—20ml—60ml=80ml,物质的量是5mol/L×0.08L=0.4mol。所以根据方程式Mg2++2OH-=Mg(OH)2↓,可知镁离子的物质的量是0.2mol,因此根据原子守恒可知金属镁的质量是0.2mol×24g/mol=4.8g;当沉淀达到最大值时消耗氢氧化钠是160ml,物质的量是0.8mol,溶液中生成得氯化钠是0.8mol,因此根据氯离子守恒可知所用HCl 的物质的量浓度为0.8mol÷0.1L=8mol/L。(3)过滤后所得滤渣中含有硅,向其中加入足量1mol/L NaOH溶液,发生反应![]() ,
,
根据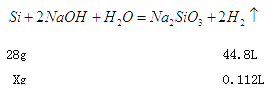
X=0.07g
则a的最小值是多少2.7g+4.8g+0.07g=7.57g。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是 .
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 .
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .CO与N2结构相似,CO分子内σ键与π键个数之比为 .
(4)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 ,甲醇分子内的O﹣C﹣H键角 (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不和水反应生成硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 2molL﹣1的盐酸跟过量的锌反应,为加快反应速率,可采用的方法是( )
A.改用适量的6molL﹣1的盐酸 B.加入数滴氯化铜溶液
C.加入适量MnO2 D.加入适量的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
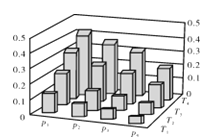
A. P1>P2>P3>P4
B. 甲醇的物质的量分数越高,反应的平衡常数越大
C. 若T1> T2> T3>T4,则该反应为放热反应
D. 缩小容积,可以提高CH3OH在混合物中的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用下图装置进行实验研究(a、b、c表示止水夹)。请评价或完善其方案:
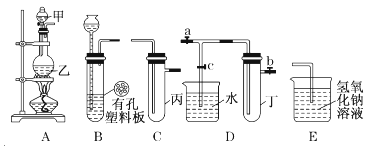
(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①氯元素在周期表中的位置为 。
②A中反应的离子方程式: 。
③E中氢氧化钠溶液的作用 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
④实验Ⅰ推出的相应结论是否合理? ,若不合理,请说明理由(若合理,无需填写) 。
⑤实验Ⅱ推出相应的结论是否合理? ,若不合理,请说明理由(若合理,无需填写) 。
(2)将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2。B中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述不正确的是
A.常温常压下,17g甲基(—14CH3)所含的中子数为8NA
B.0.1molFe与0.1molCl2充分反应,转移的电子数为0.2NA
C.标准状况下,44.8LNO与22.4LO2混合后气体的分子总数为2NA
D.1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质,其中属于电解质的是( )
①NaCl溶液
②干冰(固态的二氧化碳)
③冰醋酸(纯净的醋酸)
④铜
⑤BaSO4固体
⑥蔗糖
⑦酒精
⑧熔融的KNO3
A.①③⑤⑧ B.②③④⑤⑥⑦ C.③⑤⑧ D.①②③④⑤⑥⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com