
【题目】锂离子电池是一种二次电池,它主要依靠锂离子在两极之间移动来工作.某锂离子电池正极材料有钴酸锂(LiCoO2)、铝箔和有机物导电剂等.现利用以下流程回收正极材料中的某些资源. 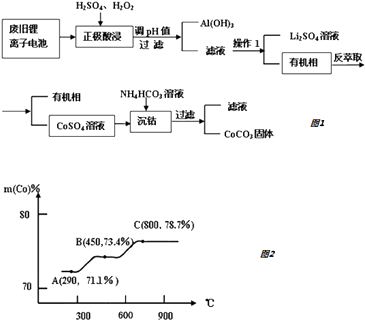
请回答下列问题:
(1)用硫酸和过氧化氢酸浸时,一般在90℃下进行,写出该步骤中LiCoO2参与的化学反应方程式 . 当有1mol LiCoO2参加反应时,得到氧化产物的质量为 .
(2)常温条件下调pH时,若使Al3+完全沉淀所需最小的pH为(保留整数).
(已知:①离子浓度等于或小于1.×10﹣6时,认为其完全沉淀; ②Al(OH)3的Ksp=1.13×10﹣33)
(3)操作1的名称是 .
(4)从平衡角度进行解释生成CoCO3固体的原因 .
(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质.Co(OH)2在空气中加热时,钴元素在固体残留物中的百分含量有如右图所示的变化.已知钴的氢氧化物加热至290℃时已完全脱水,则A点时,剩余固体的成分为(填化学式);在550﹣600℃范围内,剩余固体的成分为(填化学式).
【答案】
(1)2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O;16g
(2)5
(3)萃取分液
(4)HCO3﹣存在电离平衡:HCO3﹣?H++CO32﹣ , 当电离产生的CO32﹣浓度与溶液中Co2+浓度的积(即浓度积)大于CoCO3的Ksp时,对于溶解平衡:CoCO3(S)?Co2+(aq)+CO32﹣(aq)而言,平衡将向生成沉淀的方向移动
(5)Co2O3;CoO、Co3O4
【解析】解:(1)根据工艺流程中酸浸的过程中发生氧化还原反应有2LiCoO2+3 H2SO4+H2O2=Li2SO4+2 CoSO4+O2↑+4H2O,2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O中氧化产物是氧气,1molLiCoO2完全反应生成氧气0.5mol,其质量为16g,
所以答案是:2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O;16g;(2)离子浓度等于或小于1.0×10﹣6时,认为其完全沉淀;(OH﹣)3= ![]() =
= ![]() ,c(OH﹣)=10﹣9 molL﹣1 , c(H+)=
,c(OH﹣)=10﹣9 molL﹣1 , c(H+)= ![]() mol/L=10﹣9 molL﹣1 , pH=5,
mol/L=10﹣9 molL﹣1 , pH=5,
所以答案是:5;(3)该操作是萃取、分液,操作1的名称是萃取分液,
所以答案是:萃取分液;(4)平衡移动原理,溶液中HCO3﹣H++CO32﹣ Co2+浓度与CO32﹣ 浓度积即为浓度积大于CoCO3的Ksp 向生成沉淀的方向移动,
所以答案是:HCO3﹣存在电离平衡:HCO3﹣H++CO32﹣ , 当电离产生的CO32﹣浓度与溶液中Co2+浓度的积(即浓度积)大于CoCO3的Ksp时,对于溶解平衡:CoCO3(S) Co2+(aq)+CO32﹣(aq)而言,平衡将向生成沉淀的方向移动;(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质,Co(OH)2在空气中加热时,根据FeFe的氧化物,则Co的氧化物可能为Co2O3、CoO、Co3O4 , Co2O3中Co的含量= ![]() ×100%=71.1%、CoO中Co的含量=
×100%=71.1%、CoO中Co的含量= ![]() ×100%=78.7%、Co3O4中Co的含量=
×100%=78.7%、Co3O4中Co的含量= ![]() ×100%=73.4%,
×100%=73.4%,
所以A点成分为Co2O3 , 在550﹣600℃范围内,剩余固体的成分为Co3O4和CoO,
所以答案是:Co2O3;CoO、Co3O4 .


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】一般来说,轻、薄、疏松、滑爽的织物透气性强,穿在身上轻快、凉爽,是夏天普遍采用的衣料,各种真丝绸都具有以上特点,那么真丝绸衣服脏了应选用什么样的洗涤剂( )
A.弱碱性的合成洗涤剂
B.肥皂
C.中性的合成洗涤剂
D.纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究铁和浓硫酸反应的产物及性质,用如图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验). 
实验开始前,先打开弹簧夹通一段时间N2 , 关闭弹簧夹后,在A中滴加一定量的浓硫酸,观察实验现象,然后加热,观察到A中有白雾生成,铁片上有气泡产生.已知A中白雾是硫酸与水形成的酸雾.请回答下列问题:
(1)铁片上滴入浓硫酸未加热前没有明显现象的原因是 .
(2)加热一段时间后发现B装置中溶液褪色,取出A中的溶液少许,加入KSCN溶液未出现血红色,写出此时A中反应的化学方程式: .
(3)C装置的作用是除去二氧化硫气体中硫酸蒸汽,则盛放的溶液是 .
A.水
B.NaOH溶液
C.Na2SO3
D.NaHSO3溶液
(4)实验开始前,先通一段时间N2的目的是 .
(5)可以证明H2SO3是弱酸的实验装置是 .
(6)E中的白色沉淀是 , 该沉淀的生成表明SO2具有性.
(7)装置F的作用是 , 写出该装置中反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
(1)写出该实验中生成乙烯的化学方程式 .
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 .
a.乙烯与溴水易发生取代反应b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后试管中另一实验现象后,证明反应中有乙烯生成,请简述这种这一实验现象 .
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加图2装置以除去乙醇蒸气和SO2 , 则A中的试剂是 , B中的试剂为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的锌加入100mL18mol/L的浓硫酸中充分反应,则被还原的H2SO4的物质的量为
A.1.8molB.﹤0.9mol
C.0.9molD.在0.9mol和1.8mol之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用适当的化学用语来表示下列反应原理
(1)氢氧化亚铁放置于空气中,颜色发生改变,有关化学方程式:;
(2)小苏打溶于水,其电离方程式:;
(3)铁红中铁的化合价为: , 它与盐酸反应的离子方程式为;
(4)明矾[KAl(SO4)212H2O]能净水是由于其溶于水后生成了(写化学式);
(5)工业上制取漂白液,有关离子方程式并用双线桥标明电子得失: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途(括号内为其用途)错误的是( )
A.SiO2(制光纤)
B.Si和Ge(半导体材料)
C.钢化玻璃(汽车窗玻璃)
D.氮化硅陶瓷(作导热剂)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com