
【题目】足量的锌加入100mL18mol/L的浓硫酸中充分反应,则被还原的H2SO4的物质的量为
A.1.8molB.﹤0.9mol
C.0.9molD.在0.9mol和1.8mol之间
科目:高中化学 来源: 题型:
【题目】下列化学式与指定物质的主要成分对应正确的是
A. NaClO——漂白粉 B. NaHCO3——小苏打
C. CaCO3——熟石灰 D. KAl(SO4)2·12H2O——胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据中国新闻网报道,青岛尾气遥感检测车上岗,0.7秒测出尾气超标车辆.汽车尾气净化的反应如下:NO(g)+CO(g) ![]() N2(g)+CO2(g)△H=﹣373.4kJmol﹣1 . 下列说法正确的是( )
N2(g)+CO2(g)△H=﹣373.4kJmol﹣1 . 下列说法正确的是( )
A.升高温度,平衡常数增大
B.当v(CO2)正= ![]() v(N2)逆时,说明反应达到平衡状态
v(N2)逆时,说明反应达到平衡状态
C.增加CO的物质的量浓度,NO的转化率增大
D.增大压强,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法不合理的是( )
A.聚二氧化碳塑料是通过加聚反应制得的
B.用工业废弃物二氧化碳生产塑料,有助于缓解温室效应
C.聚二氧化碳塑料不能在空气中燃烧
D.聚二氧化碳塑料的使用会产生白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是一种二次电池,它主要依靠锂离子在两极之间移动来工作.某锂离子电池正极材料有钴酸锂(LiCoO2)、铝箔和有机物导电剂等.现利用以下流程回收正极材料中的某些资源. 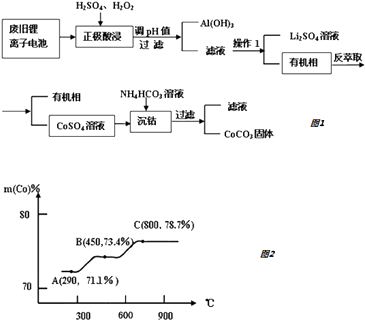
请回答下列问题:
(1)用硫酸和过氧化氢酸浸时,一般在90℃下进行,写出该步骤中LiCoO2参与的化学反应方程式 . 当有1mol LiCoO2参加反应时,得到氧化产物的质量为 .
(2)常温条件下调pH时,若使Al3+完全沉淀所需最小的pH为(保留整数).
(已知:①离子浓度等于或小于1.×10﹣6时,认为其完全沉淀; ②Al(OH)3的Ksp=1.13×10﹣33)
(3)操作1的名称是 .
(4)从平衡角度进行解释生成CoCO3固体的原因 .
(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质.Co(OH)2在空气中加热时,钴元素在固体残留物中的百分含量有如右图所示的变化.已知钴的氢氧化物加热至290℃时已完全脱水,则A点时,剩余固体的成分为(填化学式);在550﹣600℃范围内,剩余固体的成分为(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)△H=a kJmol﹣1 .
N2(g)+2CO2(g)△H=a kJmol﹣1 .
(1)已知:2NO(g)+O2(g)=2NO2(g)△H=b kJmol﹣1;CO的燃烧热为c kJmol﹣1 . 写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式 .
(2)一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/molL﹣1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
c(CO)/molL﹣1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |
①在恒容密闭容器中充入CO,NO气体,下列图象如图1正确且能说明反应达到平衡状态的是 . 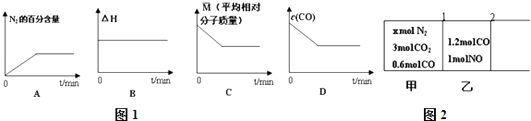
②前2s内的平均反应速率υ(N2)=mol/(Ls)(保留两位小数,下同);此温度下,该反应的平衡常数为 .
③采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx , 获得(NH4)2SO4的稀溶液.已知常温下,该溶液的PH=5,则 ![]() =(已知该温度下NH3H2O的Kb=1.7×10﹣5).若向此溶液中再加入少量 (NH4)2SO4固体,
=(已知该温度下NH3H2O的Kb=1.7×10﹣5).若向此溶液中再加入少量 (NH4)2SO4固体, ![]() 的值将(填“变大”、“不变”或“变小”).
的值将(填“变大”、“不变”或“变小”).
(3)如图2所示,用无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下达到平衡时,各部分体积分别为V甲、V乙 . 此时若去掉活塞1,不引起活塞2的移动.则x= , V甲:V乙= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作中,主要是出于实验安全考虑的是( )
A. 实验剩余的药品不能放回原试剂瓶
B. 胶头滴管不能交叉使用
C. 气体实验装置在实验前进行气密性检查
D. 点燃可燃性气体前的验纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸法钛白粉生产中的副产物(主要成分是绿矾、少量TiO2及重金属离子)制备高品质氧化铁红的工艺过程如图1: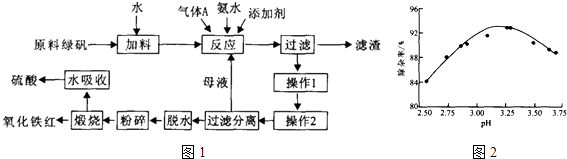
(1)原料绿矾需要加入铁粉进行预处理,其目的为(用离子方程式表示).
(2)利用氨水中和反应可以促进重金属离子水解,以便沉淀出去,如图为pH与除杂率的关系.气体A为(填化学式),调节pH适宜范围为 .
(3)操作1和操作2分别为
(4)绿矾通过脱水、锻烧等工序转化为氧化铁红.反应为:FeSO47H2O ![]() FeSO4H2O+6H2O↑:
FeSO4H2O+6H2O↑:
(5)该过程中可循环使用的物质为(填化学式).
(6)若生产1t钦白粉会产生3t含量为96.5%的绿矾原料,生产中损失5%,则高品质氧化铁红的产量为 t
(7)TiO2可用于制备海绵钛:
①已知:
(i)TiO2(g)+2C12(g)═TiC14(1)+O2(g)△H=+141kJmol﹣1
(ii)TiO2(g)+C(s)+2C12(g)═TiC14(1)+CO2(g)△H=﹣218kJmol﹣1
工业上采用(ii)制备TiC14 , 不能采用(i)的原因是 . 02Mg在高温下还原TiC14制备海绵钦的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com