
| A、同浓度,pH由大到小:c>a>b |
| B、同浓度同体积,分别与氢氧化钠中和,所需的氢氧化钠的物质的量由大到小:c>a>b |
| C、同pH,物质的量浓度由大到小:b>a>c |
| D、同pH同体积,分别于少量且质量相同的Zn片反应,反应所需时间由长到短:b>a>c |


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
| A、氧化剂与还原剂的物质的量之比为1:8 |
| B、还原产物为NH4+ |
| C、若有1 mol NO3-参加氧化反应,则转移8 mol电子 |
| D、该过程说明Fe(NO3)2溶液不宜加酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、1 mol氯化氢约含有6.02×1023个粒子 |
| C、22.4 L甲烷(CH4)所含的原子数为5 NA |
| D、2.4 g镁原子变成离子时,失去的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 电解质溶液 | HCl | AgNO3 | KOH | BaCl2 |
| pH变化 | 减小 | 增大 | 增大 | 不变 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加成-消去-取代 |
| B、消去-加成-取代 |
| C、取代-消去-加成 |
| D、取代-加成-消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
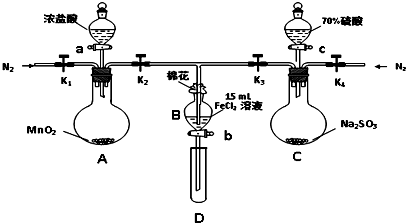
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com