
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.5mol/L亚硫酸溶液中含有的H+数日小于NA
B. 12g石墨烯(单层石墨)中含有六元环的个数为1.5NA
C. 1.2g镁在足量的氧气中燃烧,转移的电子数为0.1NA
D. lmolSO2和0.5mo102在VL的密闭容器中充分反应,生成SO3的分子数目为NA
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e- =ZnO+H2O,Ag2O+H2O+2e- =2Ag+2OH-。据此判断氧化银是
A.正极,被还原B.负极,被氧化
C.正极,被氧化D.负极,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为0.5 mol·L-1的是
A. 将20 g NaOH溶于1 L水所得的溶液
B. 将11.2 L HCl溶于水配成1 L溶液
C. 1 L含1 mol K+的K2SO4溶液
D. 将0.25 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
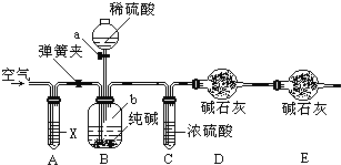
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为85.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为87.6g.试回答:
(1)鼓入空气的目的是___________,装置A中试剂X应选用___________;
(2)若没有C装置,则会导致测定结果___________(填“偏大”或“偏小”);
(3)装置B中发生反应的离子方程式______________________________;
(4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为_________(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
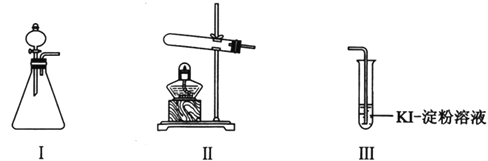
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,.向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水;草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是________________________,由此可知草酸晶体分解的产物中有_______。
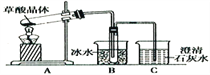
装置B的主要作用是_________________________________________________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。

①乙组的实验装置中,依次连接的合理顺序为A→B→(_____)→( )→( )→( )→I。装置H反应管中盛有的物质是__________;I中集气瓶收集到的气体主要是_________。
②能证明草酸晶体分解产物中有CO的现象是_______________________________。
(3)丙组同学欲进一步证明产物CO能否与Na2O2反应。从A~J中选用装置进行实验,最简单的装置接口连接顺序是:A→B→(_____)→J(盛Na2O2的干燥管);实验后用J中的固体进行验证的方法是:__________________________________(可另选试剂)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①H2 + CuO ![]() Cu + H2O
Cu + H2O
②CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O
③3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O
2Na2S + Na2SO3 + 3H2O
④NH4NO3 + Zn==ZnO + N2↑+ 2H2O
⑤Cu2O + 4HCl==2HCuCl2 + H2O
上述反应中,属于氧化还原反应的是__________________________(填序号)
(2)用双线桥法表示下述反应的电子转移MnO2 + 4HCl(浓)![]() MnCl2 +Cl2↑+ 2H2O________
MnCl2 +Cl2↑+ 2H2O________
(3)在反应 KIO3 + 6HI==3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为________。
(4)若反应 3Cu + 8HNO3(稀)==3Cu(NO3)2 + 2NO↑+ 4H2O中转移了3mol电子,则生成的NO气体在标况下的体积是_____________L。
(5)配平下面两个反应① ____H2O + ____Cl2 +____ SO2 ==____H2SO4 + ____HCl,____________
② ____KMnO4 + ____HCl==____KCl + ____MnCl2 + ____Cl2↑ + ____H2O(系数是1的也请填上),_____
根据以上两个反应反应,写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平。______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com