
 水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:
水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:分析 (1)用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌;
(2)锥形瓶中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水;
(3)用过氧化氢除去溶液中NaClO,用酚酞作指示剂,用盐酸滴定,重复测定,减少误差;
(4)N2H4•H2O具有强还原性,容易被过量的NaClO氧化;
(5)①碘的标准溶液具有氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中;肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色;
②根据方程式N2H4•H2O+2I2=N2↑+4HI+H2O计算.
解答 解:(1)用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒,
故选:BD,
(2)锥形瓶中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)用过氧化氢除去溶液中NaClO,用酚酞作指示剂,用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度:取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol•L-1盐酸滴定,重复上述操作2~3次,
故答案为:取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol•L-1盐酸滴定,重复上述操作2~3次;
(4)N2H4•H2O具有强还原性,容易被过量的NaClO氧化,会发生反应:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,应将NaOH和NaClO混合溶液滴入CO (NH2) 2溶液中,故分液漏斗中盛放的为,NaOH和NaClO混合溶液,
故答案为:B;N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
(5)①碘的标准溶液具有氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中;肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:溶液出现蓝色且半分钟内不消失,
故答案为:酸式;溶液出现蓝色且半分钟内不消失;
②设馏分中水合肼(N2H4•H2O)的质量分数为a,则:
N2H4•H2O+2I2=N2↑+4HI+H2O
50g 2mol
5g×a 0.018L×0.1mol/L×$\frac{250mL}{25mL}$
所以50g:5g×a=2mol:0.018L×0.1mol/L×$\frac{250mL}{25mL}$
解得a=9%,
故答案为:9%.
点评 本题考查物质制备实验、物质含量测定,注意利用题目信息判断溶液添加顺序,较好的考查学生对实验原理的理解、知识迁移应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Fe(OH)3与HCl | D. | HNO3与KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压32g O2 含2NA个原子 | |
| B. | 标准状况下11.2L H2O 含有的原子数目为1.5NA | |
| C. | 1mol的Cl- 含有NA个电子 | |
| D. | 0.5mol/L的NaCl 溶液中Cl-的个数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
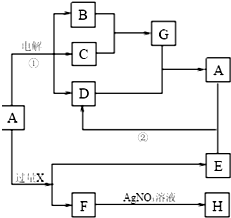 已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行):
已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行): .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子最外层电子数越多,元素金属性越强 | |
| B. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 | |
| C. | Si、P、S、Cl元素的单质与氢气化合越来越容易 | |
| D. | F-、O2-、Mg2+、Na+离子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com