
【题目】从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
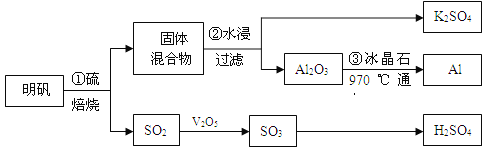
已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4+ 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为: 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是 。
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)
转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
【答案】(1)1:2 (2)AC(3)蒸发结晶(4)![]()
阳极中碳被氧化成CO2(CO)(5)NiO(OH)+H2O+e-=Ni(OH)2+OH-
(6)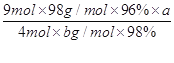 或
或![]()
【解析】
试题(1)明矾的焙烧已经给出了方程式,因此本题主要是考查氧化还原反应的特征。该方程式中发生化合价变化的只有S元素,明矾中的S元素一部分发生化合价降低,而S单质的化合价升高,因此反应中的氧化剂是明矾(KAl(SO4)2·12H2O),还原剂是单质S。
(2)步骤②是水浸明矾焙烧后的固体混合物,因此要提高浸出率,往往需要增大接触面积、充分溶解;因此粉碎固体混合物、不断搅拌都是可行的。
(3)焙烧后的固体混合物是K2SO4和Al2O3,水浸后的溶液则是易溶于水的K2SO4溶液,所以要从单一组分的溶液中得到改溶质,可以直接蒸发结晶。
(4)氧化铝电解制备铝单质,该反应方程式为![]() ;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。
;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。
(5)以Al和NiO(OH)为电极构成的碱性电池,首先判断出单质Al做负极,NiO(OH)为正极;因此放电时正极得到电子被还原,从Ni的化合价变化可以得出得失电子数目,所以充分运用电荷守恒、原子守恒,再结合反应环境可以的该正极的反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH-。
(6)计算思路:计算明矾物质的量,根据方程式计算SO2的总物质的量,根据S原子守恒H2SO4溶质的物质的量等于96%的SO2,把溶质H2SO4的物质的量转化为质量,再用溶质H2SO4的质量除以质量分数求得H2SO4溶液的总质量。计算列式为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ;②
;②![]() ;③
;③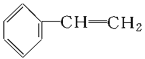 ;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦
;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦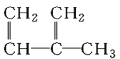 ;⑧
;⑧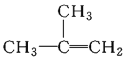
A.④和⑧B.①②和③C.⑦和⑧D.④⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑酸钠(NaSbO3)具有广泛的应用,可用作显像管、光学玻璃和各种高级玻璃的澄清剂,纺织品、塑料制品的阻燃剂,搪瓷乳白剂,制造铸件用漆的不透明填料及铁皮、钢板抗酸漆的成分。工业上用双氧水氧化法制备NaSbO33H2O的工艺流程如下:
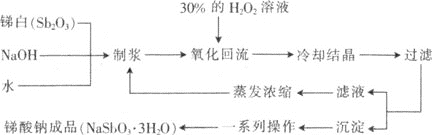
回答下列问题:
⑴NaSbO33H2O中Sb的化合价为________。
⑵先将锑白、氢氧化钠和水按一定的比例制浆,制浆过程中,搅拌、加热的目的是________。
⑶将制得的浆液加热至适当温度后,慢慢滴入30%的H2O2溶液进行氧化回流,温度不宜过高的原因是________。此过程中涉及反应如下,配平此化学方程式:
____Sb2O3 + ____H2O2 + ____NaOH + ____H2O = ____NaSbO33H2O。
⑷此流程中,可以循环利用的主要物质有________。
⑸“沉淀”主要成分为锑酸钠,流程中“一系列操作”主要包括________,产品在90~100℃下烘干,温度不宜太高的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
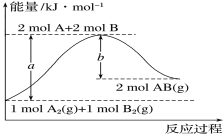
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列两个热化学方程式,回答下列问题:
2H2(g)+O2(g)![]() 2H2O(1) ΔH=571.6 kJ · mol1
2H2O(1) ΔH=571.6 kJ · mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
(1)H2的燃烧热为_______,C3H8的燃烧热为_______。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(3)现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
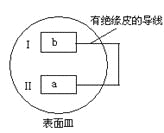
A.a是原电池的负极B.b的活泼性大于a
C.无电流产生D.b 电极上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:

mA(s)+nB(g)![]() pC(g)+qD(g)。达到平衡后,测得B的浓度为0.5mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L,当其它条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是
pC(g)+qD(g)。达到平衡后,测得B的浓度为0.5mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L,当其它条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是
A. 容积扩大到原来的两倍,平衡向逆反应方向移动
B. 化学方程式中n>p+q
C. 达到平衡后,若升高温度,平衡向逆反应方向移动
D. 达到平衡后,增加A的量,有利于提高B的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原SiHCl3(沸点:31.85℃)制备纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )

A. 装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水
B. 实验时,应先加热管式炉,再打开盛装稀硫酸的分液漏斗
C. 为鉴定制得的硅中是否含微量铁单质,需要用到的试剂为盐酸、双氧水、硫氰化钾溶液
D. 该实验中制备氢气的装置也可用于氧氧化钠稀溶液与氯化铵固体反应制备氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[双选题]铝-空气原电池通常以![]() 溶液或
溶液或![]() 溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
A.以![]() 溶液或
溶液或![]() 溶液为电解质溶液时,正极的电极反应均为
溶液为电解质溶液时,正极的电极反应均为![]()
B.以溶液为电解质溶液时,负极的电极反应为![]()
C.以![]() 溶液为电解质溶液时,负极的电极反应为
溶液为电解质溶液时,负极的电极反应为![]()
D.以![]() 溶液为电解质溶液时,负极的电极反应
溶液为电解质溶液时,负极的电极反应![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com