
A.HNO3与CaCO3 B.H2SO4与CaCO3
C.HCl与CaCO3 D.HCl 与Na2CO3
科目:高中化学 来源: 题型:
 海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图.
海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图.

查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度(°C) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.197 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| CaCO3用量 | 未加CaCO3时 | 加约四分之一时 | 加一半时 | 全部加完时 |
| 读数/g | 318.3 | 325.3 | 334.5 | 359.5 |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省宁波市高一上学期期末化学试卷(解析版) 题型:填空题
海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。

按要求回答问题:
(1)浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。下列物质不需要通过化学变化就能够从海水中获得的是 。
A.食盐 B.金属钠 C.淡水
(2)以电解食盐水为基础制取Cl2、 等产品的工业称为“氯碱工业”。
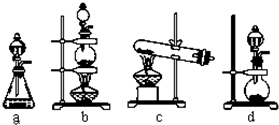
(3)实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气
MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气
(填写装置的序号)。

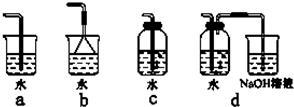
(4)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为: ;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是 (选填下列选项的编号字母)。

(5)电解熔融氯化镁所得的镁蒸气冷却后即为固体镁。下列气体中,镁蒸气可以在其氛围中冷却的是 (选填下列选项的编号字母)。
A.Cl2 B.N2 C.Ar D.空气 E.H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com