
【题目】在硫酸铜溶液中加入过量KCN,发生反应:CuSO4+4KCN=K2[Cu(CN)4]+K2SO4。
回答下列问题:
(1)基态铜原子的电子排布式为_____________。
(2)N、O、S元素分别与H形成的二元共价化合物中,既含有极性共价键,又含有非极性共价键的化合物是_____________(填化学式,写出两种)。
(3)N2O5晶体由两种离子构成,已知其阴离子(NO3-)的立体构型为平面三角形,则其阳离子(NO2+)的立体构型为_____________,阳离子中氮的杂化方式为_____________。
(4)相同条件下,SO2、CO2在水中的溶解度较大的是_______________(填分子式),理由是_________________________________________________________________。
(5)N、O元素第一电离能的大小关系为__________(用元素符号表示),原因为____________。
(6)铜晶体为面心立方最密堆积,配位数为_____________,铜的原子半径为127.8 pm,NA表示阿伏加德罗常数的值,列出铜晶体的密度计算式:_____________g·cm-3。
【答案】[Ar]3d104s1 H2O2、N2H4 直线形 sp杂化 SO2 CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在HO中的溶解度较大 N>O N元素2p3为半充满,较稳定,所以第一电离能更大 12 ![]()
【解析】
(1)Cu是29号元素,由于洪特规则,电子排布式为[Ar]3d104s1;
(2)N、O、S元素分别与H形成的二元共价化合物有:NH3、N2H4、H2O、H2O2、H2S,其中既含有极性共价键,又含有非极性共价键的化合物是H2O2(H-O-O-H)、N2H4(![]() );
);
(3)根据价层电子对互斥理论,可计算出NO2+的价层电子对数为2,故NO2+的空间构型为直线型,N的杂化方式为sp杂化;
(4)CO2空间构型为直线型,正负电荷中心重合,是非极性分子,SO2和H2O都是V型,是极性分子,根据“相似相溶”原理,极性分子易溶于极性溶剂,所以SO2在HO中的溶解度较大;
(5)N元素是第VA族,最外层的2p3为半充满,根据洪特规则,半满状态较稳定,所以第一电离能更大,故第一电离能N>O;
(6)铜晶体为面心立方最密堆积,最密堆积的配位数为12;面心立方最密堆积的晶胞中Cu原子在8个顶点和6个面心,每个晶胞中Cu的数目为![]() ,面心立方最密堆积中半径(r)和晶胞参数(a)的关系为
,面心立方最密堆积中半径(r)和晶胞参数(a)的关系为![]() ,晶胞密度
,晶胞密度![]()
![]() ;
;


科目:高中化学 来源: 题型:
【题目】碳酸二乙酯(![]() )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
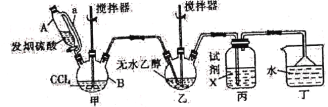
回答下列问题:
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是____________。②仪器A的侧导管a的作用是______________________。
(2)试剂X是____________,其作用是_____________________________________________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是____________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:________________________________________________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________________________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是______(三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。KClO4中氯元素的化合价是_________,具有_________(填“还原性”或“氧化性”);Fe2O3可处理产生的Na,反应为6Na + Fe2O3 =3Na2O + 2Fe,反应中Na做_________(填“还原剂”或“氧化剂”)。
(2)甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe粉和稀H2SO4 , B管中是NaOH溶液,请回答下列问题:
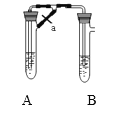
①同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是____________写出B中发生反应的所有离子方程式:___________________
②同学乙:打开a,使A管中反应一段时间再夹紧止水夹a,实验中在B管中观察到的现象是__________ ;
③同学乙打开a的目的______________,根据以上实验判断___________(填甲或乙)同学可成功。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe2+、I-、Br-的溶液中通入适量Cl2,溶液中各种离子的物质的量变化如图所示。下列有关说法正确的是( )
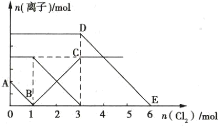
A.线段BC代表Cl-物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol·L-1
C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)反应③的ΔH_________0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时υ正_____υ逆(填“>”、“=”或“<”)。
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO(g)的浓度(mol·L-1)分别为0.2、0.1则:
①平衡时H2的转化率为________(保留一位有效数字)。
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比______________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
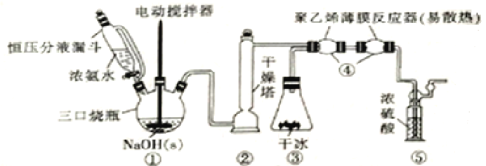
回答下列问题:
(1)装置①中用“恒压分液漏斗”代替普通的分液漏斗,其优点是_____________,滴入浓氨水并搅拌能产生大量NH3的原因是____________________,装置②干燥塔中盛放的合适干燥剂是_____________(填名称)。
(2)装置③用盛干冰装置代替实验室制备CO2的常见制备及纯化转置,其优点除装置简洁且可产生纯净干燥的CO2外,还具有的优点是____________________________________。
(3)装置④用“聚乙烯薄膜反应器”代替反应管的优点是____________,“聚乙烯薄膜反应器”中发生反应的化学方程式为_____________________________________________。
(4)从环境保护角度分析,装置⑤的作用是_____________,还可以通过观察气泡确定NH3和CO2的比例是否合适,判断的依据及不合适时的调节方案为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3分解的热化学方程式为![]() .在Co-Al催化剂体系中,压强P0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。
.在Co-Al催化剂体系中,压强P0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。
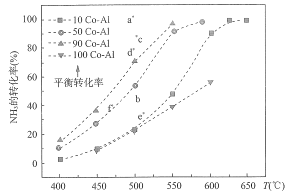
下列说法错误的是
A.活化能最小的催化剂是 90 Co-A1
B.如果增大气体流速,则b点对应的点可能为e
C.温度为T时,向体积为1L的恒容容器中加入0.8 molNH3和0.1molH2,达到平衡时,NH3的转化率为75%,则平衡常数为K=7.5
D.在两个体积均为VL的绝热密闭容器中分别投入①2 mol NH3,②3 mol H2和1mol N2,达到平衡时,NH3的体积分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液.下列说法正确的是
A. 配制过程只需要三种仪器即可完成
B. 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C. 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低
D. 需用托盘天平称量的NaClO固体的质量为148.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铝、硫酸钾和明矾的混合溶液中,硫酸根离子的浓度为0.4mol·L-1,当加入等体积0.4mol·L-1氢氧化钾溶液时,生成的沉淀恰好完全溶解。则反应后溶液中钾离子的浓度约为( )
A.0.225mol·L-1B.0.25mol·L-1C.0.45mol·L-1D.0.9mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com