
| A. | ①②③ | B. | ①②④ | C. | ②③ | D. | ①③⑤ |
科目:高中化学 来源: 题型:选择题
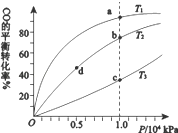
| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(b)>υ(d)v(a)>υ(c) | ||
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) | D. | 平均摩尔质量:M(b)>M(d)M(a)<M(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲烷的质量与NA个甲烷分子的质量之和相等 | |
| B. | 28g氮气与40g氩气所含的原子数目相等,都是NA个 | |
| C. | 2.3g钠由原子变成离子,失去的电子数为0.1个 | |
| D. | 18g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的离子方程式为:5Cl2+10 OH-═7Cl-+2ClO-+ClO3-+5H2O | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为5:3 | |
| C. | 上述苛性钾溶液中含有0.3mol的KOH | |
| D. | 反应后生成的ClO-和 ClO3- 两种离子在一定条件下均有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙一定是氯化钾溶液 | B. | 甲一定是氢氧化钡溶液 | ||
| C. | 丙不可能是碳酸钠溶液 | D. | 丁只能是硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,请补充完整:
,请补充完整: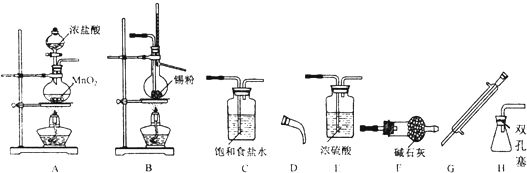
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com