
【题目】硫酸亚铁晶体(FeSO47H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质.实验步骤如下: 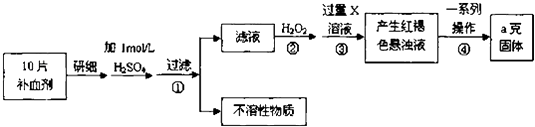
请回答下列问题:
(1)步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有(填离子符号),检验滤液中还存在Fe2+的方法为(注明试剂、现象).
(2)步骤②加入过量H2O2的目的是 .
(3)步骤③中反应的离子方程式为
(4)步骤④中一系列处理的操作步骤包括:过滤、、灼烧、、称量.
(5)若实验无损耗,则每片补血剂含铁元素的质量为g.
【答案】
(1)Fe3+;取一定量滤液,滴加少量KMnO4溶液,KMnO4溶液退色
(2)将Fe2+全部氧化为Fe3+
(3)Fe3++3NH3?H2O═Fe(OH)3+3NH4+
(4)洗涤;冷却
(5)0.07a
【解析】解:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+ , 使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.(1)含铁离子的溶液中滴加KSCN溶液后会变为红色,亚铁离子能使高锰酸钾褪色,但是铁离子不可以,故答案为:Fe3+;取一定量滤液,滴加少量KMnO4溶液,KMnO4溶液退色;(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+ , 故答案为:将Fe2+全部氧化为Fe3+;(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3H2O=Fe(OH)3↓+3NH4+ , 故答案为:Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤;冷却;(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量 ![]() =0.07ag,
=0.07ag,
故答案为:0.07a.
由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+ , 使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.(1)含铁离子的溶液中滴加KSCN溶液后会变为红色,根据亚铁离子和铁离子的性质差异来回答;(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+ , 由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;(3)步骤③是将Fe3+转化为氢氧化铁沉淀;(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;(5)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】现有两瓶无标签的无色溶波,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是
①Ca(OH)2 ②盐酸③CaCl2 ④NaOH ⑤加热
A. ②③ B. ①③ C. ①③ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不符合安全规范的是( )
A.金属钠着火时使用泡沫灭火器灭火
B.NH3泄露时向空中喷洒水雾
C.含Cl2的尾气用碱溶液处理后再排放
D.面粉生产车间应严禁烟火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出,试计算:
(1)原混合液中CO32﹣的物质的量浓度为 , Na+的物质的量浓度为 .
(2)产生的气体在标准状况下的体积L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5 . 已知:①装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2═Na2S2O5 .
②Na2S2O5晶体在空气中被氧化生成Na2SO4 . 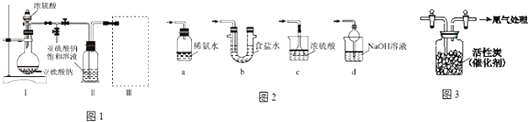
(1)装置Ⅰ中产生气体的化学方程式为 .
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 .
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(图2)(夹持仪器已略去)为(填序号).
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是 .
(5)为了研究干燥的Cl2与干燥SO2反应及进行程度.用如图3所示装置收集满干燥的Cl2 , 再通入干燥SO2 , 集气瓶中立即产生无色液体SO2Cl2 , 充分反应后,将液体和剩余气体分离.继续用NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是 , 由此可知反应后剩余气必然存在气体,综合实验信息,请写出干燥的SO2与Cl2反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨肥样品可能含有NH4HCO3、NH4Cl、.NH4NO3中的一种或几种。称取该样品1.000克,溶于水配成100mL溶液,将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL0.2 mol·L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol·L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mlL0.15 mol·L-1的硫酸才能被完全反应。下列说法正确的是
A. 1.000g样品中一定含有NH4HCO30.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4Cl
C. 原样品的含氨量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于气体摩尔体积的几种说法正确的是( )
A.22.4L任何气体的物质的量均为1mol
B.非标准状况下,1mol任何气体不可能占有22.4L体积
C.0.4molH2、0.2molO2、和0.4molCO2组成的混合气体,在标准状况下约为22.4L
D.同温、同压下,相同质量的CO和CO2具有相同的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com