
(8分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
科目:高中化学 来源:2012届高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版) 题型:实验题
(8分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省德州市跃华学高三12月月考化学试卷(解析版) 题型:实验题
(8分)现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪 器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________ mL。
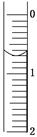
(4)滴定。当____________________ ________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录:
|
滴定次数 实验数据(mL) |
1 |
2 |
3 |
4 |
|
V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.实验处理:
(1)某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
指出他的计算的不合理之处:____________ _ _。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(福建卷解析版) 题型:实验题
( 15 分)
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
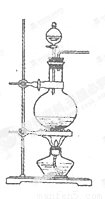
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如图所示(夹持器具已略去)。
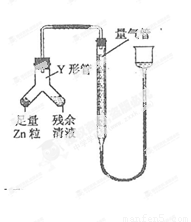
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_(排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版) 题型:实验题
(8分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
|
滴定次数 |
待测溶液 体积(mL) |
标准酸体积 |
|
|
滴定前的刻度 (mL) |
滴定后的刻度 (mL) |
||
|
第一次 |
10.00 |
0.40 |
20.50 |
|
第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com