
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
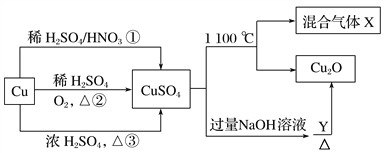
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B. 相对于途径①③,途径②更好地体现了绿色化学思想
C. Y可能是麦芽糖或葡萄糖
D. 1 mol CuSO4在1 100 ℃时分解所得混合气体X中O2可能为0.75 mol
【答案】D
【解析】A项,途径①反应的实质为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,产生2mol的NO消耗2mol硝酸,则同时提供2mol的H+,所以8mol的H+中硫酸提供6mol,这样消耗硫酸最少,为3mol,混酸中H2SO4与HNO3物质的量之比最好为3∶2,A正确;B项,途径②2Cu+O2![]() 2CuO,CuO+H2SO4=CuSO4+H2O,没有生成有毒气体,而铜与浓硫酸或硝酸反应都会生成有毒气体,故B正确;C项,向CuSO4溶液中加入过量的NaOH溶液生成Cu(OH)2悬浊液,再加入含有醛基的物质,如葡萄糖、醛类等,并加热煮沸,就会发生氧化还原反应生成砖红色的Cu2O沉淀,因此Y可以是葡萄糖溶液,故C正确;D项,1molCuSO4在1100℃分解反应为:4CuSO4=2Cu2O+4SO2+3O2,所得混合气体X为SO2,O2,其中存在可逆反应SO2+O2
2CuO,CuO+H2SO4=CuSO4+H2O,没有生成有毒气体,而铜与浓硫酸或硝酸反应都会生成有毒气体,故B正确;C项,向CuSO4溶液中加入过量的NaOH溶液生成Cu(OH)2悬浊液,再加入含有醛基的物质,如葡萄糖、醛类等,并加热煮沸,就会发生氧化还原反应生成砖红色的Cu2O沉淀,因此Y可以是葡萄糖溶液,故C正确;D项,1molCuSO4在1100℃分解反应为:4CuSO4=2Cu2O+4SO2+3O2,所得混合气体X为SO2,O2,其中存在可逆反应SO2+O2![]() SO3,所以O2不一定为0.75mol,故D错误。
SO3,所以O2不一定为0.75mol,故D错误。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】若以w1和w2分别表示浓度为xmol·L–1和2xmol·L–1硫酸的质量分数,则下列推断正确的是(硫酸浓度越大密度越大):
A. w2>2w1 B. 2w1=w2 C. 2w2=w1 D. w1<w2<2w1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+4HCl![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. 5NH4NO3=4N2↑ +2HNO3+9H2O中,反应中发生氧化反应和发生还原反应的氮元素物质的量之比为5∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。
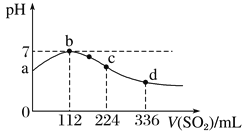
下列分析正确的是
A. 原H2S溶液的物质的量浓度为0.05 mol/L
B. 氢硫酸的酸性比亚硫酸的酸性强
C. b点水的电离程度比c点水的电离程度大
D. a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氯水能导电,所以氯气是电解质
B.碳酸钙不溶于水,所以它是非电解质
C.固体磷酸是电解质,所以磷酸在熔融状态下和溶于水时都能导电
D.胆矾虽不能导电,但它属于强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子显电中性的原因是( )
A. 构成原子的各种微粒均不带电
B. 原子核外电子数大于核内质子数
C. 原子核所带电量和核外电子的电量相等,但电性相反
D. 核内质子数等于核电荷数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在共价化合物中,元素化合价有正负的主要原因是 ( )
A. 电子有得失 B. 电子既有得失又有电子对偏移
C. 共用电子对有偏移 D. 有金属元素的存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. NH3极易溶于水,可用于工业制冷剂
B. HNO3具有酸性,可用于制备硝酸盐原料
C. NH4 NO3易溶于水,可用于制造高温材料
D. N2难溶于水,可用于合成氨原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com