
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述不正确的是( )

A.WZ的水溶液呈中性
B.Y的最高价氧化物的水化物是强酸
C.元素非金属性的顺序为Z>Y>X
D.该新化合物中Y满足8电子稳定结构
【答案】B
【解析】
W、X、Y、Z为同一短周期元素,根据图知,X能形成4个共价键、Z能形成1个共价键,则X位于IVA族、Z位于VIIA族,且Z核外最外层电子数是X核外电子数的一半,Z最外层7个电子,则X原子核外有14个电子,为Si元素,Z为Cl元素,该阴离子中Cl元素为-1价、X元素为+4价,根据化合价的代数和为-1价,Y为-3价,所以Y为P元素,根据阳离子所带电荷可知,W为Na元素,通过以上分析,W、X、Y、Z分别是Na、Si、P、Cl元素。
A. WZ为NaCl,为强酸强碱盐,其水溶液呈中性,A正确,不选;
B. Y为P,其最高价氧化物的水化物是磷酸,为中强酸,B错误,可选;
C. X、Y、Z分别是Si、P、Cl元素,非金属性的顺序为Cl>P>Si,C正确,不选;
D. Y为P元素,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子一个电子,所以P原子达到8电子结构,即Y原子达到8电子结构,D正确,不选;
故选:B。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B. 图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )

A.甲、乙、丙三物质转化如图所示,则![]()
B.1molCO完全燃烧生成稳定氧化物放出热量为![]() ,则2
,则2 ![]()
![]() ,
,![]()
C.若![]() ,
,![]() ,故在某容器中充入
,故在某容器中充入![]() 与
与![]() 充分反应后,放出的热量为
充分反应后,放出的热量为![]()
D.常温下,稀HCl和稀NaOH溶液反应生成![]() 放出热量为
放出热量为![]() ,其热化学方程式为
,其热化学方程式为![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液(pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
____Fe2+ +_______ ______+____ _______ +____H2O=____Fe(OH)3 ↓+____HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
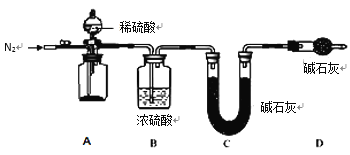
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。

下列叙述不正确的是( )
A.放电时,a电极反应为I2Br-+2e- =2I-+ Br-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每减少0.65g,溶液中有0.02mol I-- 被氧化
D.充电时,a电极接外电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、Ti、Mn、Cu都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)Mn位于元素周期表的_________区,Mn2+的价层电子排布图为_____。
(2)N原子核外有______种空间运动状态不同的电子。NO2+ 的立体构型是_________,与它互为等电子体的分子有________(写出一种)。
(3)Cu2+与NH3可形成[Cu(NH3)4]2+配离子,0.5 mol [Cu(NH3)4]2+中含有σ键的个数为_____。已知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是___________________________________________________________。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物甲中碳原子的杂化方式为___________,乙中所有原子的第一电离能由大到小的顺序为___________。化合物乙的沸点明显高于化合物甲,主要原因是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由U形管、质量为mg的铁棒、质量为mg的碳棒和1L0.2mol·L-1CuCl2溶液组成如图所示装置,下列说法不正确的是( )

A. 打开K,铁棒上有紫红色物质析出
B. 闭合K,碳棒上有紫红色固体析出
C. 闭合K,碳棒表面发生的电极反应为Cu2++2e-=Cu
D. 闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)______25℃,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=_________;
②若所得混合溶液pH=2,则a:b=__________。
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
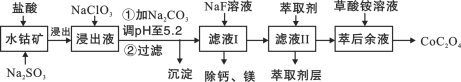
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
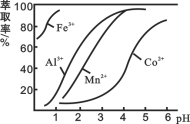
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com