
【题目】(7分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A![]() H++HA- HA-
H++HA- HA-![]() H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显 (填“酸性”“中性”或“碱性”)。理由是
(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2A溶液中,下列粒子浓度关系式正确的是 。A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3)已知0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”、“>”或“=”),理由是 。
【答案】(7分)(1)碱性 A2-+H2O![]() HA-+OH- (2)BCD (3)< H2A第一步电离产生的H+,抑制了HA-的电离
HA-+OH- (2)BCD (3)< H2A第一步电离产生的H+,抑制了HA-的电离
【解析】
试题(1)根据酸的电离方程式可知,第一步是完全电离的,而第二步是不完全电离的。存在电离平衡。所以Na2A溶于水水解,溶液显碱性,离子方程式是A2-+H2O![]() HA-+OH-。
HA-+OH-。
(2)A不正确,因为溶液中不存在H2A分子;根据电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),C正确;根据物料守恒可知c(Na+)=2c(A2-)+2c(HA-),D正确;将选项C和D合并即得到c(OH-)=c(H+)+c(HA-),B正确,答案选BDC。
(3)由于H2A第一步完全电离,电离产生的H+,抑制了HA-的电离,所以0.1 mol·L-1H2A溶液中氢离子的物质的量浓度小于0.11mol/L。


科目:高中化学 来源: 题型:
【题目】N2+3H2 ![]() 2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
A. 降低体系温度能加快反应速率
B. 使用恰当的催化剂能加快反应速率,又能提高N2的转化率
C. 达到反应限度时各组分含量之比一定等于3∶1∶2
D. 若在反应的密闭容器加入1mol N2和过量的H2,最后不能生成2mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是: ,
,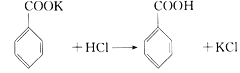 。已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃;苯甲酸的熔点为121.7℃,沸点为249℃,常温下,在水中的溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
。已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃;苯甲酸的熔点为121.7℃,沸点为249℃,常温下,在水中的溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

试根据上述信息回答下列问题:
(1)操作I的名称是________,乙醚溶液中所溶解的主要成分是____________;
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是____(填“a”、“b”、“c” 或“d”),收集乙醚产品的适宜温度为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmol O2,同时生成2nmol NO2 ②混合气体的密度不再变化
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变 ⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A. 以上全部 B. ①②③⑤ C. ②③⑤⑥ D. ①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g)![]() xC(g) ΔΗ=QkJ/mol ,在密闭容器中进行,表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
xC(g) ΔΗ=QkJ/mol ,在密闭容器中进行,表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则

A. T1>T2 ,P1>P2 ,m+n>x ,Q>0
B. T1<T2 ,P1<P2 ,m+n<x ,Q>0
C. T1>T2 ,P1<P2 ,m+n<x ,Q<0
D. T1<T2 ,P1<P2 ,m+n>x ,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
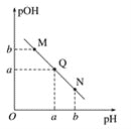
图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com