
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
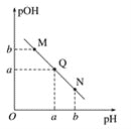
图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
【答案】3<pH<5 不变 11 取一小段pH试纸放在表面皿上,用洁净的玻璃棒蘸取氨水溶液滴在pH试纸上,然后与标准比色卡对照读取pH值 10-5 c(NH4+)· c(OH-)/c(NH3.H2O) b Q Q或N
【解析】
在25 ℃时,CH3COOH和NH3·H2O的电离常数相等,在两者浓度相同的稀溶液中,两者的电离度相同,两者pH之和为14。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,若是10 mL pH=3的盐酸加水稀释至1 000 mL,pH将增大到5,由于稀释过程中醋酸的电离度变大,故溶液pH数值范围为3~5之间,溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]=c(CH3COO-)c(H+)/[c(CH3COOH)c(OH-)c(H+)]=![]() ,温度不变,该值不变,故不变。
,温度不变,该值不变,故不变。
②因为25 ℃时,CH3COOH和NH3·H2O的电离常数相等,故25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=14-3=11。用pH试纸测定该氨水pH的操作方法为:取一小段pH试纸放在表面皿上,用洁净的玻璃棒蘸取氨水溶液滴在pH试纸上,然后与标准比色卡对照读取pH值。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=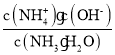 ,25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=11,则氨水电离平衡常数约为
,25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=11,则氨水电离平衡常数约为![]() 10-5。
10-5。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中Kb=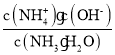 不变,但是溶液中
不变,但是溶液中![]() 减小,则c(NH4+)/c(NH3·H2O)变大,选b。
减小,则c(NH4+)/c(NH3·H2O)变大,选b。
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液。由图中信息可知,只有Q点的pOH=pH,故图中M、Q、N三点所示溶液呈中性的点是Q。图中M点溶液显酸性,且M点是因为醋酸过量而显酸性,水的电离受到抑制。N点溶液显碱性,可能是仅由醋酸根离子的水解使溶液显碱性,这样会促进水的电离;也可能是因为NaOH过量使溶液显碱性,这样会抑制水的电离。Q点为中性溶液,水的电离没有受到抑制(或醋酸的电离程度与醋酸根离子的水解程度相同,对水的电离的影响相互抵消),故M、Q、N三点所示溶液中水的电离程度最大的点可能是Q或N。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】(7分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A![]() H++HA- HA-
H++HA- HA-![]() H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显 (填“酸性”“中性”或“碱性”)。理由是
(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2A溶液中,下列粒子浓度关系式正确的是 。A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3)已知0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”、“>”或“=”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物与生产、生活、生命和环境息息相关。
(1)NO加速臭氧层被破坏,其反应过程如图所示。
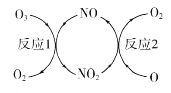
①NO的作用是________________________。
②已知:O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
反应l:O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
则反应2的热化学方程式为____________________________。
(2)肌红蛋白(Mb)是肌肉内储存氧的蛋白质,构成肌红蛋白的甘氨酸(H2NCH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下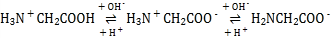 三种离子的物质的量分数(δ)与[
三种离子的物质的量分数(δ)与[![]() ]的关系如图所示。
]的关系如图所示。
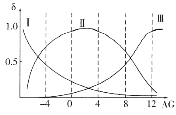
①溶液呈中性时,三种离子浓度由大到小的顺序为______________________。
②向AG=12的溶液中加入过量NaOH溶液时,主要反应的离子方程式为______________。
(3)肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
①计算37℃时,上述反应的平衡常数K=__________kPa-1(气体和溶液中的溶质分别用分压和物质的量浓度表示)。
②37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
③温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
④研究发现,v正=k正·c(Mb)·p(O2),v逆=k
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将乙烯分别通过如图所示的装置,下列叙述正确的是( )

A. 二者都褪色且原理相同
B. 二者都能证明乙烯中有碳碳双键
C. 二者都可用于除去乙烷中混有的乙烯
D. 二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某弱酸溶液中存在电离平衡HA![]() H++A-,下列叙述不正确的是:
H++A-,下列叙述不正确的是:
A. 溶液中离子浓度的关系满足:c(H+) = c(OH-)+c(A-)
B. 常温下,加入NaA固体可使HA的电离常数增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 0.10mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示:

下列有关叙述正确的是
A. X分子中所有原子处于同一平面
B. X、Y、Z均能和NaOH溶液反应
C. 可用NaHCO3溶液鉴别Y和Z
D. 1 mol Y跟足量H2反应,最多消耗3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com