
【题目】一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,乙是
![]()
A.HClB.NaHCO3 C.KOHD.FeCl2
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中通入一定量的X,发生反应:mX(g)![]() nY(g)+Z(g)△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
nY(g)+Z(g)△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
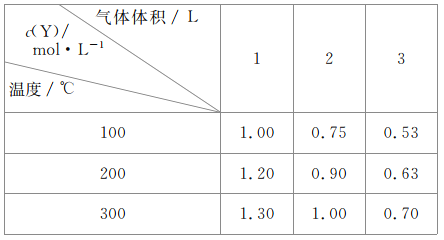
下列说法正确的是
A.m>n+1
B.温度不变,压强增大,Y的体积分数减少
C.Q<0
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. NaHS水解反应:HS-+H2O ![]() H3O++S2-
H3O++S2-
B. Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O
C. 过量的SO2通入到漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3-
D. Na2CO3水溶液中存在平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
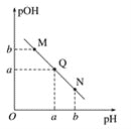
图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 通常状况下,11.2 LH2所含的氢原子数为NA
B. 实验室中用含4mol H2SO4的浓硫酸跟足量铜片加热反应制得的SO2分子数为2NA
C. 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
D. 2.4 g Mg与足量稀HCl完全反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯化铁溶液溶解铜片:Fe3++ Cu=Fe2++ Cu2+
B. 氯气与水反应:Cl2 + H2O ![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
C. 硝酸银溶液中加入过量氨水:Ag+ + NH3·H2O=AgOH↓+ NH4+
D. Ca(HCO3)2溶液与少量NaOH溶液反应: Ca2++ HCO3-+ OH-=CaCO3↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
①钴不是主族元素;②![]() Cl2不能长期稳定地存在;③Mg的原子结构示意图为
Cl2不能长期稳定地存在;③Mg的原子结构示意图为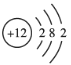 ;④鸟粪石中两种阳离子为Mg2+、NH4+
;④鸟粪石中两种阳离子为Mg2+、NH4+
A.①②③④B.仅①②④C.仅②③④D.仅①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com