
【题目】在容积可变的密闭容器中通入一定量的X,发生反应:mX(g)![]() nY(g)+Z(g)△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
nY(g)+Z(g)△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
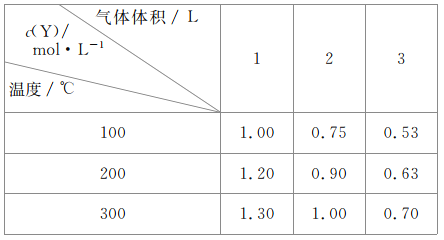
下列说法正确的是
A.m>n+1
B.温度不变,压强增大,Y的体积分数减少
C.Q<0
D.体积不变,温度升高,平衡向逆反应方向移动
【答案】B
【解析】
根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,根据平衡移动原理,增大体积,平衡向体积增大的方向移动,当体积相同时,温度升高,Y的浓度增大,即平衡正向移动,所以此反应的正向为吸热反应。
A.在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,则有m<n+1,A项错误;
B.温度不变,压强增大,平衡向逆反应方向移动,则Y的质量分数减少,B项正确;
C.当体积相同时,温度升高,Y的浓度增大,即平衡正向移动,所以此反应的正向为吸热反应,则Q>0,C项错误;
D.反应的正向为吸热反应,体积不变,温度升高,平衡正向移动,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】“软电池”采用一张薄层纸片作为传导体,一面镀Zn,另一面镀MnO2。电池总反应为Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )
A.该电池的正极为ZnO
B.Zn电极附近溶液的pH不变
C.电池正极的电极反应为2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中加入4mol A和6mol B,发生如下反应:2A(g)+3B(g)![]() 4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是
4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是
A. 前10min反应的平均速率V(C)=0.10mol/L·min
B. 反应达平衡时B的平衡浓度是1.5mol/L
C. 恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L
D. 10min后向容器中加入A,保持温度不变重新平衡时A的转化率大于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物与生产、生活、生命和环境息息相关。
(1)NO加速臭氧层被破坏,其反应过程如图所示。
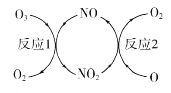
①NO的作用是________________________。
②已知:O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
反应l:O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
则反应2的热化学方程式为____________________________。
(2)肌红蛋白(Mb)是肌肉内储存氧的蛋白质,构成肌红蛋白的甘氨酸(H2NCH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下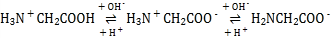 三种离子的物质的量分数(δ)与[
三种离子的物质的量分数(δ)与[![]() ]的关系如图所示。
]的关系如图所示。
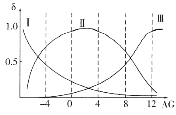
①溶液呈中性时,三种离子浓度由大到小的顺序为______________________。
②向AG=12的溶液中加入过量NaOH溶液时,主要反应的离子方程式为______________。
(3)肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
①计算37℃时,上述反应的平衡常数K=__________kPa-1(气体和溶液中的溶质分别用分压和物质的量浓度表示)。
②37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
③温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
④研究发现,v正=k正·c(Mb)·p(O2),v逆=k
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2molN2和6molH2混合发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减小一倍,平衡将向 移动(填“向左”、“向右”或“不”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将向___________移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将___________移动(填“向 左”、“向右”或“不”)。达到新平衡后,容器内温度 (填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S为二元弱酸。20 ℃时,向0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A. 通入HCl气体之前: c(S2-)>c(HS-)>c(OH-)>c(H+)
B. c(HS-)=c(S2-)的碱性溶液中: c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
C. pH=7的溶液中: c(Cl-)=c(HS-)+2c(H2S)
D. c(Cl-)=0.100 mol·L-1的溶液中: c(OH-)-c(H+)=c(H2S)-c(S2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com