
ΓΨΧβΡΩΓΩ“ΜΕ®Έ¬Ε»œ¬Θ§‘Ύ2LΒΡΟή±’»ίΤς÷–Φ”»κ4mol AΚΆ6mol BΘ§ΖΔ…ζ»γœ¬Ζ¥”ΠΘΚ2AΘ®gΘ©+3BΘ®gΘ©![]() 4CΘ®gΘ©+DΘ®gΘ©Ζ¥”Π10minΚσ¥οΤΫΚβΘ§¥Υ ±DΒΡ≈®Ε»ΈΣ0.5mol/LΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
4CΘ®gΘ©+DΘ®gΘ©Ζ¥”Π10minΚσ¥οΤΫΚβΘ§¥Υ ±DΒΡ≈®Ε»ΈΣ0.5mol/LΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. «Α10minΖ¥”ΠΒΡΤΫΨυΥΌ¬ VΘ®CΘ©=0.10mol/LΓΛmin
B. Ζ¥”Π¥οΤΫΚβ ±BΒΡΤΫΚβ≈®Ε» «1.5mol/L
C. ΚψΈ¬œ¬ΫΪΖ¥”Π»ίΤςΧεΜΐΥθ–Γ“ΜΑκΘ§‘ρDΒΡΤΫΚβ≈®Ε»–Γ”Ύ1.0mol/L
D. 10minΚσœρ»ίΤς÷–Φ”»κAΘ§±Θ≥÷Έ¬Ε»≤Μ±δ÷Ί–¬ΤΫΚβ ±AΒΡΉΣΜ·¬ ¥σ”Ύ50%
ΓΨ¥πΑΗΓΩB
ΓΨΫβΈωΓΩ
“ΜΕ®Έ¬Ε»œ¬Θ§‘Ύ2LΒΡΟή±’»ίΤς÷–Φ”»κ4mol AΚΆ6mol BΘ§Ζ¥”Π10minΚσ¥οΒΫΤΫΚβΘ§¥Υ ±DΒΡ≈®Ε» «0.5molL-1Θ§‘ρΘΚ
2AΘ®gΘ©+3BΘ®gΘ©4CΘ®gΘ©+DΘ®gΘ©
Τπ Φ≈®Ε»Θ®mol/LΘ©ΘΚ2 3 0 0
±δΜ·≈®Ε»Θ®mol/LΘ©ΘΚ1 1.5 2 0.5
ΤΫΚβ≈®Ε»Θ®mol/LΘ©ΘΚ1 1.5 2 0.5
AΘ°«Α10 minΡΎΖ¥”ΠΒΡΤΫΨυΥΌ¬ Π‘Θ®CΘ©=![]() =0.2 molL-1min-1Θ§―ΓœνA¥μΈσΘΜ
=0.2 molL-1min-1Θ§―ΓœνA¥μΈσΘΜ
BΘ°”……œ ωΦΤΥψΩ…÷ΣΘ§Ζ¥”Π¥οΤΫΚβ ±cΘ®BΘ©=1.5 molL-1Θ§―ΓœνB’ΐ»ΖΘΜ
CΘ°ΚψΈ¬œ¬Θ§ΫΪ―Ι«Ω±δΈΣ‘≠ά¥ΒΡ2±ΕΘ§»ίΤςΧεΜΐΥθ–Γ“ΜΑκΘ§Ζ¥”ΠΤχΧεΤχΧεΧεΜΐ≤Μ±δΘ§ΤΫΚβ≤Μ“ΤΕ·Θ§DΒΡ≈®Ε»ΈΣ‘≠ΤΫΚβ2±ΕΘ§Φ¥DΒΡ≈®Ε»Β»”Ύ1 molL-1Θ§―ΓœνC¥μΈσΘΜ
DΘ°‘≠ΤΫΚβ÷–AΒΡΉΣΜ·¬ ΈΣ![]() ΓΝ100%=50%Θ§10 minΚσœρ»ίΤς÷–Φ”»κAΘ§‘Ό¥Έ¥οΤΫΚβ ±Θ§AΒΡΉΣΜ·¬ –Γ”Ύ‘≠ΤΫΚβΘ§Ι ‘Ό¥Έ¥οΤΫΚβ ±Θ§AΒΡΉΣΜ·¬ “ΜΕ®–Γ”Ύ50%Θ§―ΓœνD¥μΈσΘΜ
ΓΝ100%=50%Θ§10 minΚσœρ»ίΤς÷–Φ”»κAΘ§‘Ό¥Έ¥οΤΫΚβ ±Θ§AΒΡΉΣΜ·¬ –Γ”Ύ‘≠ΤΫΚβΘ§Ι ‘Ό¥Έ¥οΤΫΚβ ±Θ§AΒΡΉΣΜ·¬ “ΜΕ®–Γ”Ύ50%Θ§―ΓœνD¥μΈσΘΜ
¥πΑΗ―ΓBΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΜ·―ßΖ¥”ΠΔΌΘΚFeΘ®sΘ©+CO2Θ®gΘ©![]() FeOΘ®sΘ©+COΘ®gΘ©Θ§ΤδΤΫΚβ≥Θ ΐΈΣK1Θ§Μ·―ßΖ¥”ΠΔΎΘΚFeΘ®sΘ©+H2OΘ®gΘ©
FeOΘ®sΘ©+COΘ®gΘ©Θ§ΤδΤΫΚβ≥Θ ΐΈΣK1Θ§Μ·―ßΖ¥”ΠΔΎΘΚFeΘ®sΘ©+H2OΘ®gΘ©![]() FeOΘ®sΘ©+H2Θ®gΘ©Θ§ΤδΤΫΚβ≥Θ ΐΈΣK2Θ§‘ΎΈ¬Ε»973KΚΆ1173K«ιΩωœ¬Θ§K1ΓΔK2ΒΡ÷ΒΖ÷±π»γœ¬ΘΚ
FeOΘ®sΘ©+H2Θ®gΘ©Θ§ΤδΤΫΚβ≥Θ ΐΈΣK2Θ§‘ΎΈ¬Ε»973KΚΆ1173K«ιΩωœ¬Θ§K1ΓΔK2ΒΡ÷ΒΖ÷±π»γœ¬ΘΚ
Έ¬Ε» | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
«κΆξ≥…œ¬Ν–Έ ΧβΘΚ
(1)Ά®Ιΐ±μΗώ÷–ΒΡ ΐ÷ΒΩ…“‘ΆΤΕœΘΚΖ¥”ΠΔΌ «______Θ®ΧνΓΑΈϋ»»Γ±ΜρΓΑΖ≈»»Γ±Θ©Ζ¥”ΠΓΘ
(2)œ÷”–Ζ¥”ΠΔέΘΚCO2Θ®gΘ©+H2Θ®gΘ©![]() COΘ®gΘ©+H2OΘ®gΘ©Θ§«κΡψ–¥≥ωΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK3ΒΡ±μ¥ο ΫΘΚK3=_______ΓΘ
COΘ®gΘ©+H2OΘ®gΘ©Θ§«κΡψ–¥≥ωΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK3ΒΡ±μ¥ο ΫΘΚK3=_______ΓΘ
(3)‘ΎœύΆ§Έ¬Ε»œ¬Θ§ΗυΨίΖ¥”ΠΔΌ”κΔΎΩ…ΆΤΒΦ≥ωK3”κK1ΓΔK2÷°ΦδΒΡΙΊœΒ Ϋ____________Θ§Ψί¥ΥΙΊœΒ ΫΦΑ…œ±μ ΐΨίΘ§“≤ΡήΆΤΕœ≥ωΖ¥”ΠΔέ «_____Θ®ΧνΓΑΈϋ»»Γ±ΜρΓΑΖ≈»»Γ±Θ©Ζ¥”ΠΓΘ
(4)“Σ ΙΖ¥”ΠΔέ‘Ύ“ΜΕ®ΧθΦΰœ¬Ϋ®ΝΔΒΡΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§Ω…≤…»ΓΒΡ¥κ ©”–______ Θ®Χν–¥Ή÷ΡΗ–ρΚ≈Θ§œ¬Ά§Θ©Θ°
AΘ°‘ω¥σ―Ι«Ω BΘ°ΧεΜΐ≤Μ±δ ±≥δ»κœΓ”–ΤχΧε CΘ°…ΐΗΏΈ¬Ε» DΘ° Ι”ΟΚœ ΒΡ¥ΏΜ·ΦΝ EΘ°‘ΎΧεœΒ÷–ΆΕ»κ…ΌΝΩP2O5ΙΧΧε
(5)“―÷ΣΔέΒΡΩ…ΡφΖ¥”ΠCO (g) ΘΪH2O(g) ![]() CO2 (g) ΘΪH2 (g) Θ§830K ±Θ§»τΤπ Φ ±ΘΚc(CO)ΘΫ2mol/LΘ§c(H2O)ΘΫ3mol/LΘ§ΤΫΚβ ±COΒΡΉΣΜ·¬ ΈΣ60%Θ§Υ°’τΤχΒΡΉΣΜ·¬ ΈΣ___________ΘΜKΒΡ ΐ÷ΒΈΣ_____________ΓΘ830KΘ§»τ÷ΜΫΪΤπ Φ ±c(H2O)ΗΡΈΣ6mol/LΘ§‘ρΥ°’τΤχΒΡΉΣΜ·¬ ΈΣ_______ΓΘ
CO2 (g) ΘΪH2 (g) Θ§830K ±Θ§»τΤπ Φ ±ΘΚc(CO)ΘΫ2mol/LΘ§c(H2O)ΘΫ3mol/LΘ§ΤΫΚβ ±COΒΡΉΣΜ·¬ ΈΣ60%Θ§Υ°’τΤχΒΡΉΣΜ·¬ ΈΣ___________ΘΜKΒΡ ΐ÷ΒΈΣ_____________ΓΘ830KΘ§»τ÷ΜΫΪΤπ Φ ±c(H2O)ΗΡΈΣ6mol/LΘ§‘ρΥ°’τΤχΒΡΉΣΜ·¬ ΈΣ_______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν––π ω’ΐ»ΖΒΡ «
A. 24 g ΟΨ”κ27 g¬Ν÷–Θ§Κ§”–œύΆ§ΒΡ÷ Ή” ΐ
B. Ά§Β»÷ ΝΩΒΡ―θΤχΚΆ≥τ―θ÷–Θ§ΒγΉ” ΐœύΆ§
C. 1 mol÷ΊΥ°”κ1 molΥ°÷–Θ§÷–Ή” ΐ±»ΈΣ2ΓΟ1
D. 1 mol““ΆιΚΆ1 mol““œ©÷–Θ§Μ·―ßΦϋ ΐœύΆ§
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ≤ΜΆ§ΧθΦΰœ¬Ζ÷±π≤βΒΟΖ¥”Π2SO2+O2![]() 2SO3ΒΡΜ·―ßΖ¥”ΠΥΌ¬ Θ§Τδ÷–±μ ΨΗΟΖ¥”ΠΫχ––ΉνΩλΒΡ «Θ® Θ©
2SO3ΒΡΜ·―ßΖ¥”ΠΥΌ¬ Θ§Τδ÷–±μ ΨΗΟΖ¥”ΠΫχ––ΉνΩλΒΡ «Θ® Θ©
A. v(SO2)ΘΫ4 molΓΛL-1ΓΛmin-1B. v (O2)ΘΫ3 molΓΛL-1ΓΛmin-1
C. v (SO3)="0.1" molΓΛL-1ΓΛs-1D. v (O2)ΘΫ0.1molΓΛL-1ΓΛs-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Οή±’»ίΤς÷–ΖΔ…ζ»γœ¬Ζ¥”ΠΘΚXΘ®gΘ©+3YΘ®gΘ©2ZΘ®gΘ©ΘΜΓςHΘΦ0Θ°…œΆΦ±μ ΨΗΟΖ¥”ΠΒΡΥΌ¬ Θ®vΘ©Υφ ±Φδ
Θ®tΘ©±δΜ·ΒΡΙΊœΒΘ§t2ΓΔt3ΓΔt5 ±ΩΧΆβΫγΧθΦΰ”–ΥυΗΡ±δΘ§ΒΪΕΦΟΜ”–ΗΡ±δΗςΈο÷ ΒΡ≥θ ΦΦ”»κΝΩΓΘœ¬Ν–ΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©

A. ![]() ±Φ”»κΝΥ¥ΏΜ·ΦΝB.
±Φ”»κΝΥ¥ΏΜ·ΦΝB. ![]() ±ΫΒΒΆΝΥΈ¬Ε»
±ΫΒΒΆΝΥΈ¬Ε»
C. ![]() ±‘ω¥σΝΥ―Ι«ΩD.
±‘ω¥σΝΥ―Ι«ΩD. ![]() ±ΦδΡΎΉΣΜ·¬ ΉνΗΏ
±ΦδΡΎΉΣΜ·¬ ΉνΗΏ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ»ίΜΐΩ…±δΒΡΟή±’»ίΤς÷–Ά®»κ“ΜΕ®ΝΩΒΡX,ΖΔ…ζΖ¥”Π:mX(g)![]() nY(g)+Z(g)ΓςH=QkJΓΛmol-1ΓΘΖ¥”Π¥οΒΫΤΫΚβ ±,YΒΡΈο÷ ΒΡΝΩ≈®Ε»”κΈ¬Ε»ΓΔΤχΧεΧεΜΐΒΡΙΊœΒ»γ±μΥυ Ψ:
nY(g)+Z(g)ΓςH=QkJΓΛmol-1ΓΘΖ¥”Π¥οΒΫΤΫΚβ ±,YΒΡΈο÷ ΒΡΝΩ≈®Ε»”κΈ¬Ε»ΓΔΤχΧεΧεΜΐΒΡΙΊœΒ»γ±μΥυ Ψ:
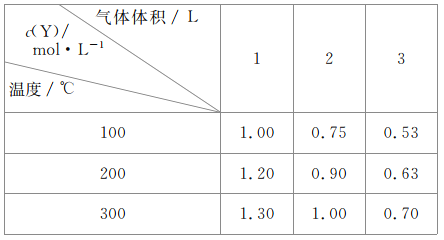
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A.mΘΨn+1
B.Έ¬Ε»≤Μ±δΘ§―Ι«Ω‘ω¥σΘ§YΒΡΧεΜΐΖ÷ ΐΦθ…Ό
C.QΘΦ0
D.ΧεΜΐ≤Μ±δΘ§Έ¬Ε»…ΐΗΏΘ§ΤΫΚβœρΡφΖ¥”ΠΖΫœρ“ΤΕ·
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§Ω…ΡφΖ¥”Π![]() ¥οΒΫΤΫΚβΘ§»τΘΚ
¥οΒΫΤΫΚβΘ§»τΘΚ
Θ®1Θ©AΓΔBΓΔCΕΦ «ΤχΧεΘ§Φθ–Γ―Ι«ΩΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§‘ρ![]() ____Θ®ΧνΓΑ>Γ±ΓΑ<Γ±ΜρΓΑ=Γ±Θ©pΓΘ
____Θ®ΧνΓΑ>Γ±ΓΑ<Γ±ΜρΓΑ=Γ±Θ©pΓΘ
Θ®2Θ©AΓΔC «ΤχΧεΘ§Εχ«“![]() Θ§‘ω¥σ―Ι«ΩΩ… ΙΤΫΚβΖΔ…ζ“ΤΕ·Θ§‘ρΤΫΚβ“ΤΕ·ΒΡΖΫœρ «__________ΓΘ
Θ§‘ω¥σ―Ι«ΩΩ… ΙΤΫΚβΖΔ…ζ“ΤΕ·Θ§‘ρΤΫΚβ“ΤΕ·ΒΡΖΫœρ «__________ΓΘ
Θ®3Θ©Φ”»»ΚσΘ§Ω… ΙCΒΡ÷ ΝΩ‘ωΦ”Θ§‘ρ’ΐΖ¥”Π «__________Θ®ΧνΓΑΖ≈»»Γ±ΜρΓΑΈϋ»»Γ±Θ©Ζ¥”ΠΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–άκΉ”ΖΫ≥Χ Ϋ”κΥυ ω ¬ ΒœύΖϊ«“’ΐ»ΖΒΡ «
A. NaHSΥ°ΫβΖ¥”ΠΘΚHSΘ≠ΘΪH2O ![]() H3OΘΪΘΪS2Θ≠
H3OΘΪΘΪS2Θ≠
B. Fe(OH)2”κœΓœθΥαΖ¥”ΠΘΚ2HΘΪΘΪFe(OH)2=Fe2ΘΪΘΪ2H2O
C. ΙΐΝΩΒΡSO2Ά®»κΒΫΤ·ΑΉΖέ»ή“Κ÷–ΘΚClOΘ≠ΘΪSO2ΘΪH2O=HClOΘΪHSO3-
D. Na2CO3Υ°»ή“Κ÷–¥φ‘ΎΤΫΚβΘΚCO32Θ≠+H2O![]() HCO3Θ≠+OHΘ≠
HCO3Θ≠+OHΘ≠
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―–ΨΩΒΣΒΡ―θΜ·ΈοΓΔΧΦΒΡ―θΜ·ΈοΒ»¥σΤχΈέ»ΨΈοΒΡ¥ΠάμΨΏ”–÷Ί“Σ“β“εΓΘ
I. “―÷ΣΘΚΔΌN2(g)ΘΪO2(g)=2NO(g) ΠΛHΘΫΘΪ180.5kJΓΛmolΘ≠1 ΔΎCOΒΡ»Φ…’»»ΓςH= - 283 kJΓΛmolΘ≠1
Θ®1Θ©Τϊ≥Β≈≈ΤχΙήΡΎΑ≤ΉΑΒΡ¥ΏΜ·ΉΣΜ·ΤςΘ§Ω… ΙΈ≤Τχ÷–÷ς“ΣΈέ»ΨΈοΘ®NOΚΆCOΘ©ΉΣΜ·ΈΣΈόΕΨΒΡ¥σΤχ―≠ΜΖΈο÷ Θ§ΗΟΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣ_________________________________________________ΓΘ
Θ®2Θ©“ΜΕ®Έ¬Ε»œ¬Θ§‘ΎΚψ»ίΟή±’»ίΤς÷–≥δ»κ1 molNOΚΆ2 molCOΫχ––ΗΟΖ¥”ΠΘ§œ¬Ν–Ρή≈–ΕœΖ¥”Π¥οΒΫΜ·―ßΤΫΚβΉ¥Χ§ΒΡ «_______ΓΘ
ΔΌΒΞΈΜ ±ΦδΡΎœϊΚΡa mo1 COΒΡΆ§ ±…ζ≥…2a mol NO
ΔΎΜλΚœΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ≤Μ‘ΌΗΡ±δ
ΔέΜλΚœΤχΧε÷–NOΚΆCOΒΡΈο÷ ΒΡΝΩ÷°±»±Θ≥÷≤Μ±δ
ΔήΜλΚœΤχΧεΒΡΟήΕ»≤Μ‘ΌΗΡ±δ
II. ≥τ―θ «άμœκΒΡ―ΧΤχΆ―œθ ‘ΦΝΘ§ΤδΆ―œθΖ¥”ΠΈΣ2NO2(g)ΘΪO3(g)![]() N2O5(g)ΘΪO2(g)Θ§œρΦΉΓΔ““ΝΫΗωΧεΜΐΕΦΈΣ1.0 LΒΡΚψ»ίΟή±’»ίΤς÷–Ζ÷±π≥δ»κ2.0 mol NO2ΚΆ1.0 mol O3Θ§Ζ÷±π‘ΎT1ΓΔT2Έ¬Ε»œ¬Θ§Ψ≠Ιΐ“ΜΕΈ ±ΦδΚσ¥οΒΫΤΫΚβΓΘΖ¥”ΠΙΐ≥Χ÷–n(O2)Υφ ±ΦδΘ®tΘ©±δΜ·«ιΩωΦϊœ¬±μΘΚ
N2O5(g)ΘΪO2(g)Θ§œρΦΉΓΔ““ΝΫΗωΧεΜΐΕΦΈΣ1.0 LΒΡΚψ»ίΟή±’»ίΤς÷–Ζ÷±π≥δ»κ2.0 mol NO2ΚΆ1.0 mol O3Θ§Ζ÷±π‘ΎT1ΓΔT2Έ¬Ε»œ¬Θ§Ψ≠Ιΐ“ΜΕΈ ±ΦδΚσ¥οΒΫΤΫΚβΓΘΖ¥”ΠΙΐ≥Χ÷–n(O2)Υφ ±ΦδΘ®tΘ©±δΜ·«ιΩωΦϊœ¬±μΘΚ
t/s | 0 | 3 | 6 | 12 | 24 | 36 |
ΦΉ»ίΤςΘ®T1Θ©n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
““»ίΤςΘ®T2Θ©n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
Θ®3Θ©T1___T2Θ®Χν>ΓΔ<Μρ=Θ§œ¬Ά§Θ©Θ§ΗΟΖ¥”ΠΠΛH___0 ΓΘΦρ ωάμ”…________________________________ΓΘ
Θ®4Θ©ΦΉ»ίΤς÷–Θ§0~3sΡΎΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(NO2)=______________________ΓΘ
Θ®5Θ©ΦΉ»ίΤς÷–NO2ΤΫΚβΉΣΜ·¬ ΈΣ________Θ§T1 ±ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣ_______________________ΓΘ
III. ΫΪNO2(g)ΉΣΜ·ΈΣN2O4(g)Θ§‘Ό“‘
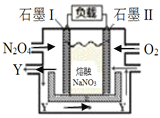
Θ®6Θ© ·ΡΪIΈΣ______ΦΪΘ®―ΓΧν’ΐΓΔΗΚΘ©Θ§YΜ·―ß ΫΈΣ_________ΓΘ
Θ®7Θ©IIΒγΦΪΖ¥”Π ΫΈΣ_________________________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com