
【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1 ②CO的燃烧热△H= - 283 kJ·mol-1
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列能判断反应达到化学平衡状态的是_______。
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
t/s | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1___T2(填>、<或=,下同),该反应ΔH___0 。简述理由________________________________。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=______________________。
(5)甲容器中NO2平衡转化率为________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g),再以
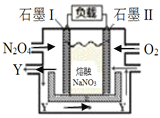
(6)石墨I为______极(选填正、负),Y化学式为_________。
(7)II电极反应式为_________________________________________。
【答案】 2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H=-746.5kJ/mol ②③ > < T1温度下反应速率更快,所以温度更高,T1>T2;T2条件下平衡时,生成n(O2)更多,说明降温平衡正向移动,所以ΔH<0 0.24mol·L-1·s-1 80% 20 L/mol 负 N2O5 O2 +4e- +2N2O5 =4NO3-
N2(g) +2CO2(g) △H=-746.5kJ/mol ②③ > < T1温度下反应速率更快,所以温度更高,T1>T2;T2条件下平衡时,生成n(O2)更多,说明降温平衡正向移动,所以ΔH<0 0.24mol·L-1·s-1 80% 20 L/mol 负 N2O5 O2 +4e- +2N2O5 =4NO3-
【解析】I. (1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质生成物为氮气和二氧化碳,反应的化学方程式为2NO+2CO![]() N2+2CO2;根据①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,②CO的燃烧热△H= - 283 kJ·mol-1,热化学方程式为CO(g)+
N2+2CO2;根据①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,②CO的燃烧热△H= - 283 kJ·mol-1,热化学方程式为CO(g)+ ![]() O2(g)= CO2(g) △H= - 283 kJ·mol-1,根据盖斯定律,将②×2-①得2NO(g)+2CO(g)
O2(g)= CO2(g) △H= - 283 kJ·mol-1,根据盖斯定律,将②×2-①得2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H=(- 283 kJ·mol-1)×2-(+180.5kJ·mol-1)=-746.5kJ/mol,故答案为:2NO(g)+2CO(g)
N2(g) +2CO2(g) △H=(- 283 kJ·mol-1)×2-(+180.5kJ·mol-1)=-746.5kJ/mol,故答案为:2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H=-746.5kJ/mol;
N2(g) +2CO2(g) △H=-746.5kJ/mol;
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行2NO+2CO![]() N2+2CO2。①单位时间内消耗a mo1 CO的同时生成2a mol NO,表示逆反应速率大于正反应速率,不是平衡状态,故错误;②该反应前后气体的质量不变,物质的量减少,混合气体的平均相对分子质量不再改变,表示气体的物质的量不变,能够说明达到了平衡状态,故正确;③混合气体中NO和CO的起始物质的量之比与反应的物质的量之比不同,因此随着反应的进行,物质的量之比发生变化,当物质的量之比保持不变,能够说明达到了平衡状态,故正确;④混合气体的体积和质量始终不变,说明始终密度不变,不能说明是平衡状态,故错误;故选②③;
N2+2CO2。①单位时间内消耗a mo1 CO的同时生成2a mol NO,表示逆反应速率大于正反应速率,不是平衡状态,故错误;②该反应前后气体的质量不变,物质的量减少,混合气体的平均相对分子质量不再改变,表示气体的物质的量不变,能够说明达到了平衡状态,故正确;③混合气体中NO和CO的起始物质的量之比与反应的物质的量之比不同,因此随着反应的进行,物质的量之比发生变化,当物质的量之比保持不变,能够说明达到了平衡状态,故正确;④混合气体的体积和质量始终不变,说明始终密度不变,不能说明是平衡状态,故错误;故选②③;
II. (3)向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,发生反应2NO2(g)+O3(g)![]() N2O5(g)+O2(g),根据表格数据,T1温度下建立平衡需要的时间短,说明T1>T2,平衡时,T1温度下n(O2)大于T2温度下n(O2),说明降低温度,平衡正向移动,正反应为放热反应,ΔH<0,故答案为:>;<;T1温度下反应速率更快,所以温度更高,T1>T2;T2条件下平衡时,生成n(O2)更多,说明降温平衡正向移动,所以ΔH<0;
N2O5(g)+O2(g),根据表格数据,T1温度下建立平衡需要的时间短,说明T1>T2,平衡时,T1温度下n(O2)大于T2温度下n(O2),说明降低温度,平衡正向移动,正反应为放热反应,ΔH<0,故答案为:>;<;T1温度下反应速率更快,所以温度更高,T1>T2;T2条件下平衡时,生成n(O2)更多,说明降温平衡正向移动,所以ΔH<0;
(4)甲容器中,0~3s内的平均反应速率v(O2)=  =0.12 mol·L-1·s-1,则v(NO2)=2 v(O2)= 0.24 mol·L-1·s-1,故答案为:0.24 mol·L-1·s-1;
=0.12 mol·L-1·s-1,则v(NO2)=2 v(O2)= 0.24 mol·L-1·s-1,故答案为:0.24 mol·L-1·s-1;
(5)平衡时,甲容器中O2为0.80mol,则反应的NO2为1.60mol,NO2平衡转化率为![]() ×100%=80%;T1时该反应的平衡常数K=
×100%=80%;T1时该反应的平衡常数K=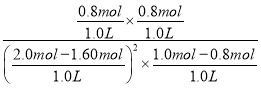 = 20 L/mol,故答案为:80%;20 L/mol;
= 20 L/mol,故答案为:80%;20 L/mol;
III.(6)通入氧气的电极为正极,即石墨II电极为正极,则石墨I为负极;以N2O4、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,N2O4在负极失电子发生氧化反应,元素化合价升高为+5价,氧化物为N2O5,故答案为:负;N2O5;
(7)根据图示,N2O4在负极(石墨I)失电子发生氧化反应生成Y,电极反应式为N2O4+2NO3--2e-=2N2O5,Y和氧气在石墨II电极上发生还原反应生成NO3-,电极反应式为O2 +4e- +2N2O5 =4NO3-,故答案为:O2 +4e- +2N2O5 =4NO3-。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中加入4mol A和6mol B,发生如下反应:2A(g)+3B(g)![]() 4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是
4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是
A. 前10min反应的平均速率V(C)=0.10mol/L·min
B. 反应达平衡时B的平衡浓度是1.5mol/L
C. 恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L
D. 10min后向容器中加入A,保持温度不变重新平衡时A的转化率大于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一种丰富的资源,工业上可从海水中提取多种物质,广泛应用于生活、生产、科技等方面。如图是某工厂对海水资源进行综合利用的示意图。

回答下列问题:
(1)流程图中操作a的名称为____。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是_____(填化学式)
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是____。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____。
②操作b是在___氛围中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。A与E同主族,D与F同主族,且A与D能形成两种液态化合物;B的某种单质是自然界中硬度最大的物质,C与D形成的化合物是大气常见污染物之一。请回答下列问题:
(1)F在元素周期表中的位置是______________,D、E、F三种元素其简单离子半径由大到小的顺序是_______________________用离子符号表示
(2)元素A、C、F形成的化合物(CA4)2F中含有的化学键为_________________。
(3)元素B、C的最高价氧化物对应水化物酸性较强的是填化学式__________,写出该酸的浓溶液与少量铜粉反应的化学方程式_______________________________。
(4)写出由A、C形成的18电子分子的结构式为________________________。
(5)处理含![]() 废水的方法之一是在微生物的作用下,
废水的方法之一是在微生物的作用下,![]() 被D的常见单质氧化成
被D的常见单质氧化成![]() ,同时生成C的简单氢化物,该反应的离子方程式为_____________________。
,同时生成C的简单氢化物,该反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系不能通过一步反应完成的是()
A.Na→NaOH→NaClO→HClO
B.Al→Al2O3→Al(OH)3→AlCl3
C.S→SO2→H2SO4→CuSO4
D.Fe→Fe(SO4)3→Fe(OH)3→Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S为二元弱酸。20 ℃时,向0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A. 通入HCl气体之前: c(S2-)>c(HS-)>c(OH-)>c(H+)
B. c(HS-)=c(S2-)的碱性溶液中: c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
C. pH=7的溶液中: c(Cl-)=c(HS-)+2c(H2S)
D. c(Cl-)=0.100 mol·L-1的溶液中: c(OH-)-c(H+)=c(H2S)-c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品“三盐”(3PbO·PbSO4·H2O),主要制备流程如下:

(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为 ____________________________。
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为____________(写化学式)。
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为____________________________;滤液2中溶质主要成分为________(写化学式)。
(4)步骤⑥合成三盐的化学方程式为 _______________________________________。
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤干净的方法是 ___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的化合物A存在如下转化关系:

已知B为黄绿色气体单质。请完成下列问题:
(1)A的化学式________。
(2)向C的溶液中滴加适量KSCN溶液,无明显现象,再滴加几滴B的水溶液,溶液呈血红色。 用离子方程式表示该过程________、________。
(3)若D为金属,则D的化学式________ (写出2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。
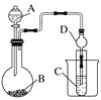
(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com