
����Ŀ����ˮ��һ�ַḻ����Դ����ҵ�ϿɴӺ�ˮ����ȡ�������ʣ��㷺Ӧ��������������Ƽ��ȷ��档��ͼ��ij�����Ժ�ˮ��Դ�����ۺ����õ�ʾ��ͼ��

�ش��������⣺
��1������ͼ�в���a������Ϊ____��
��2����ҵ�ϴӺ�ˮ����ȡ��NaCl����������ȡ������Ҫ�������£���ʳ��ˮ����ͨ������A����ͨ������B����ַ�Ӧ����˵õ�����C����ҺD��������C���ռ����Ƶô��
������A��B��CO2��NH3��������AӦ��_____(�ѧʽ)
����ҺD����Ҫ����NH4Cl��NaHCO3�����ʣ���ҵ��������ҺD��ͨ��NH3��������ϸСʳ�ο�������ȴ����������NaHCO3�ĸ���ƷNH4Cl���壬��ͨ��NH3��������____��
��3��þ��һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�Ӻ�ˮ����ȡ��
����Ҫ��֤������ˮMgCl2�в���NaCl����IJ���������_____��
�ڲ���b����___��Χ�н��У����ڿ����м��ȣ��������Mg(OH)Cl��д���йط�Ӧ�Ļ�ѧ����ʽ��_____��
���𰸡������ᾧ(������) NH3 ����NH4+��Ũ�ȣ�������NH4Cl������������NaHCO3ת��ΪNa2CO3���������� �ýྻ�IJ�˿պȡ�������壬���ھƾ��ƻ��������ա�����ɫ�����������֤��������ˮ�Ȼ�þ�����в����Ȼ���(����ɫ��ӦҲ��) HCl(����) MgCl2��6H2O![]() Mg(OH)Cl��HCl��5H2O
Mg(OH)Cl��HCl��5H2O
��������
(1)����Һ�з�������������������ᾧ�ķ�����
(2)�ٸ�����ȡ�����ԭ�����͵��Ȼ�����Һ������ͨ�백����������̼������̼�����ƾ��壬����̼�����ƾ�����Ƶô��
�ڸ��ݰ�ˮ�����笠������������ӣ�����笠���Ũ���������Ȼ�淋���������������Һ������ǿ��ʹ̼������ת��Ϊ�ܽ�Ƚϴ��̼���ƣ���������Ȼ�淋Ĵ��ȣ�
(3)�ٸ�����ɫ��Ӧ�����Ƿ���NaCl��
�����ֱ���ڿ����м���MgCl26H2O����Mg2+��ˮ������Mg(OH)Cl��HCl��ͨ��HCl����������ˮ�⡣
(1)������ͼ��֪������a�ǴӺ�ˮ�з�������Σ�������Һ�з�����������ʣ�Ӧ���������ᾧ�ķ�����
(2)���͵��Ȼ�����Һ������ͨ�백����������̼������̼�����ƾ��壬����̼�����ƾ�����Ƶô��
�ڰ�������ˮ�����ɰ�ˮ����ˮ�����笠������������ӣ�����NH4+��Ũ�ȣ������ڳ���ƽ��������NH4Cl�ķ�����У���Һ������ǿ������NaHCO3ת��ΪNa2CO3������������������Ȼ�淋Ĵ��ȣ�
(3)���ò�˿պȡ�������壬���ھƾ��ƻ��������գ�����ɫ�����������֤��������ˮ�Ȼ�þ�����в����Ȼ��ƣ�
�����ֱ���ڿ����м���MgCl26H2O����Mg2+��ˮ������Mg(OH)Cl��HCl��ͨ��HCl����������ˮ�⣻�䷴Ӧ����ʽΪ��MgCl26H2O![]() Mg(OH)Cl+HCl��+5H2O��
Mg(OH)Cl+HCl��+5H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 24 g þ��27 g���У�������ͬ��������
B. ͬ�������������ͳ����У���������ͬ
C. 1 mol��ˮ��1 molˮ�У���������Ϊ2��1
D. 1 mol�����1 mol��ϩ�У���ѧ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£����淴Ӧ![]() �ﵽƽ�⣬����
�ﵽƽ�⣬����
��1��A��B��C�������壬��Сѹǿ��ƽ��������Ӧ�����ƶ�����![]() ____���>����<����=����p��
____���>����<����=����p��
��2��A��C�����壬����![]() ������ѹǿ��ʹƽ�ⷢ���ƶ�����ƽ���ƶ��ķ�����__________��
������ѹǿ��ʹƽ�ⷢ���ƶ�����ƽ���ƶ��ķ�����__________��
��3�����Ⱥ�ʹC���������ӣ�������Ӧ��__________������ȡ������ȡ�����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��������ʵ�������ȷ����
A. NaHSˮ�ⷴӦ��HS����H2O ![]() H3O����S2��
H3O����S2��
B. Fe(OH)2��ϡ���ᷴӦ��2H����Fe(OH)2=Fe2����2H2O
C. ������SO2ͨ�뵽Ư����Һ�У�ClO����SO2��H2O=HClO��HSO3-
D. Na2CO3ˮ��Һ�д���ƽ�⣺CO32��+H2O![]() HCO3��+OH��
HCO3��+OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��Һ�еĵ��뷽��ʽ��д������ǣ�������
A. NaHCO3===Na++H++![]()
B. NH4NO3===![]() +
+![]()
C. NaHSO4===Na++H++![]()
D. Ba��OH��2===Ba2++2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������˵����ȷ����
A. ͨ��״���£�11.2 LH2��������ԭ����ΪNA
B. ʵ�������ú�4mol H2SO4��Ũ���������ͭƬ���ȷ�Ӧ�Ƶõ�SO2������Ϊ2NA
C. 0.1 mol��L��1��NaHSO4��Һ�У������ӵ���Ŀ֮��Ϊ0.2NA
D. 2.4 g Mg������ϡHCl��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.1mol��L��1��������ҺpH���±����������е�֪ʶ����Ϣ�����жϣ�����˵����ȷ����
���� | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 9.7 | 4.0 |
A. �����£�HSO3����ˮ������ǿ�����������
B. ����ˮ�м�������NaHCO3���壬��������HClO��Ũ��
C. Na2CO3 ��Һ�д������¹�ϵ��c(Na��)��c(H��)=c(CO32��)��c(HCO3��)��c(OH��)
D. �����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о����������̼��������ȴ�����Ⱦ��Ĵ���������Ҫ������
I. ��֪����N2(g)��O2(g)=2NO(g) ��H����180.5kJ��mol��1 ��CO��ȼ������H= - 283 kJ��mol��1
��1�������������ڰ�װ�Ĵ�ת��������ʹβ������Ҫ��Ⱦ�NO��CO��ת��Ϊ���Ĵ���ѭ�����ʣ��÷�Ӧ���Ȼ�ѧ����ʽΪ_________________________________________________��
��2��һ���¶��£��ں����ܱ������г���1 molNO��2 molCO���и÷�Ӧ���������жϷ�Ӧ�ﵽ��ѧƽ��״̬����_______��
�ٵ�λʱ��������a mo1 CO��ͬʱ����2a mol NO
�ڻ�������ƽ����Է����������ٸı�
�����������NO��CO�����ʵ���֮�ȱ��ֲ���
�����������ܶȲ��ٸı�
II. ��������������������Լ�����������ӦΪ2NO2(g)��O3(g)![]() N2O5(g)��O2(g)����ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⡣��Ӧ������n(O2)��ʱ�䣨t���仯������±���
N2O5(g)��O2(g)����ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⡣��Ӧ������n(O2)��ʱ�䣨t���仯������±���
t/s | 0 | 3 | 6 | 12 | 24 | 36 |
��������T1��n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
��������T2��n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
��3��T1___T2����>��<��=����ͬ�����÷�Ӧ��H___0 ����������________________________________��
��4���������У�0~3s�ڵ�ƽ����Ӧ����v(NO2)=______________________��
��5����������NO2ƽ��ת����Ϊ________��T1ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ_______________________��
III. ��NO2(g)ת��ΪN2O4(g)������
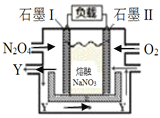
��6��ʯīIΪ______����ѡ������������Y��ѧʽΪ_________��
��7��II�缫��ӦʽΪ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʯ�ҷ�������ˮ�У�һ��ʱ���ﵽƽ�⣺Ca(OH)2(s)![]() Ca2+(aq)+
Ca2+(aq)+
2OH-(aq),����������ȷ���ǣ� ��
A. ����Һ���ȣ���Һ��pH����
B. ����������Һ�м���CaO����Һ��pH����
C. ����Һ�м���Na2CO3��Һ�������е�Ca(OH)2�Ĺ�������
D. ����Һ�м���������NaOH���壬�����е�Ca(OH)2�Ĺ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com