
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 通常状况下,11.2 LH2所含的氢原子数为NA
B. 实验室中用含4mol H2SO4的浓硫酸跟足量铜片加热反应制得的SO2分子数为2NA
C. 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
D. 2.4 g Mg与足量稀HCl完全反应,转移的电子数为0.2NA
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2molN2和6molH2混合发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减小一倍,平衡将向 移动(填“向左”、“向右”或“不”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将向___________移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将___________移动(填“向 左”、“向右”或“不”)。达到新平衡后,容器内温度 (填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一种丰富的资源,工业上可从海水中提取多种物质,广泛应用于生活、生产、科技等方面。如图是某工厂对海水资源进行综合利用的示意图。

回答下列问题:
(1)流程图中操作a的名称为____。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是_____(填化学式)
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是____。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____。
②操作b是在___氛围中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某弱酸溶液中存在电离平衡HA![]() H++A-,下列叙述不正确的是:
H++A-,下列叙述不正确的是:
A. 溶液中离子浓度的关系满足:c(H+) = c(OH-)+c(A-)
B. 常温下,加入NaA固体可使HA的电离常数增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 0.10mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。A与E同主族,D与F同主族,且A与D能形成两种液态化合物;B的某种单质是自然界中硬度最大的物质,C与D形成的化合物是大气常见污染物之一。请回答下列问题:
(1)F在元素周期表中的位置是______________,D、E、F三种元素其简单离子半径由大到小的顺序是_______________________用离子符号表示
(2)元素A、C、F形成的化合物(CA4)2F中含有的化学键为_________________。
(3)元素B、C的最高价氧化物对应水化物酸性较强的是填化学式__________,写出该酸的浓溶液与少量铜粉反应的化学方程式_______________________________。
(4)写出由A、C形成的18电子分子的结构式为________________________。
(5)处理含![]() 废水的方法之一是在微生物的作用下,
废水的方法之一是在微生物的作用下,![]() 被D的常见单质氧化成
被D的常见单质氧化成![]() ,同时生成C的简单氢化物,该反应的离子方程式为_____________________。
,同时生成C的简单氢化物,该反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S为二元弱酸。20 ℃时,向0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A. 通入HCl气体之前: c(S2-)>c(HS-)>c(OH-)>c(H+)
B. c(HS-)=c(S2-)的碱性溶液中: c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
C. pH=7的溶液中: c(Cl-)=c(HS-)+2c(H2S)
D. c(Cl-)=0.100 mol·L-1的溶液中: c(OH-)-c(H+)=c(H2S)-c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___92.2kJ(填“>”、“=”或“<”),原因是_______________。
②使用催化剂,该反应△H_____(填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为_____kJ.
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________________。
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:
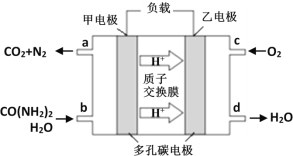
回答下列问题:
电池中的负极为_____(填“甲”或“乙”),甲的电极反应式为_____________,
电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为_____L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com