
【题目】氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___92.2kJ(填“>”、“=”或“<”),原因是_______________。
②使用催化剂,该反应△H_____(填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为_____kJ.
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________________。
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:
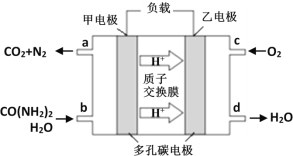
回答下列问题:
电池中的负极为_____(填“甲”或“乙”),甲的电极反应式为_____________,
电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为_____L。
【答案】< 由于该反应是可逆反应,反应物无法全部转化为生成物 不变 391 2NH3(g)+CO2(g)== CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol 甲 CO(NH2)2+H2O﹣6e﹣== CO2↑+N2↑+6H+ 33.6
【解析】
(1)①合成氨反应为可逆反应,不可能进行到底,故在实际生产中1 mol N2和3 mol H2不可能生成2 mol NH3,放出的热量也必定小于92 kJ;
②催化剂改变反应速率不改变化学平衡及△H;
③ΔH=反应物的键能之和—生成物的键能之和,据此分析作答;
(2)①根据盖斯定律计算;
②该电池CO(NH2)2在负极失电子生成二氧化碳和氮气,氧气在正极反应生成水,电解质溶液中含氢离子,该反应的总方程式为: 2CO(NH2)2+3O2 = 2CO2 + 2N2 + 4H2O,据此分析作答;
(1)①N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,N2和H2反应生成2 mol NH3时放出的热量为92.2 kJ,是指1 mol氮气和3 mol的氢气完全反应生成2 mol的氨气放出的热量为92.2 kJ,1mol N2和3 molH2放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.2 kJ,
2NH3(g) ΔH=-92 kJ·mol-1,N2和H2反应生成2 mol NH3时放出的热量为92.2 kJ,是指1 mol氮气和3 mol的氢气完全反应生成2 mol的氨气放出的热量为92.2 kJ,1mol N2和3 molH2放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.2 kJ,
故答案为:<;由于该反应是可逆反应,反应物无法全部转化为生成物;
②催化剂改变反应速率不改变化学平衡,反应热不变,
故答案为:不变;
③已知:分别破坏1 mol N≡N键、1 mol HH键需要吸收的能量为:946 kJ、436 kJ,设破坏1 mol NH键需要吸收的能量为x,根据N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,焓变=反应物总键能生成物的总键能,即946 kJ/mol+3×436 kJ/mol6x = -92.2 kJ/mol,解得x=391 kJ/mol,即破坏1 mol NH键需要吸收的能量为:391 kJ;
2NH3(g) ΔH=-92 kJ·mol-1,焓变=反应物总键能生成物的总键能,即946 kJ/mol+3×436 kJ/mol6x = -92.2 kJ/mol,解得x=391 kJ/mol,即破坏1 mol NH键需要吸收的能量为:391 kJ;
故答案为:391;
(2)①由Ⅰ. 2NH3(g)+CO2(g)= NH2CO2NH4(s) H = -159.5kJmol-1
Ⅱ.NH2CO2NH4(s)= CO(NH2)2(s)+H2O(g) △H = +116.5kJmol-1
Ⅲ. H2O(l)=H2O(g) △H=+44.0kJmol-1
结合盖斯定律可知,①+②-③得到2NH3(g)+CO2(g)= CO(NH2)2(s)+H2O(l),其△H = 159.5 kJmol1+(+116.5kJmol1)(+44.0kJmol1)=87.0kJmol1,则CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)== CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol,
故答案为:2NH3(g)+CO2(g)== CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol;
②根据图示可知,甲电极上CO(NH2)2反应生成二氧化碳和氮气,N元素化合价升高,失电子,为电源的负极,电解质溶液为酸性,则其电极反应式为:CO(NH2)2+H2O﹣6e﹣== CO2↑+N2↑+6H+,该反应的总方程式为: 2CO(NH2)2+3O2 = 2CO2 + 2N2 + 4H2O,根据关系式2 CO(NH2)2![]() 3O2可知,电池工作时,理论上每净化1mol尿素,消耗O2的体积为1.5 mol
3O2可知,电池工作时,理论上每净化1mol尿素,消耗O2的体积为1.5 mol ![]() 22.4 L/mol = 33.6 L,
22.4 L/mol = 33.6 L,
故答案为:甲;CO(NH2)2+H2O﹣6e﹣== CO2↑+N2↑+6H+;33.6。


科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 通常状况下,11.2 LH2所含的氢原子数为NA
B. 实验室中用含4mol H2SO4的浓硫酸跟足量铜片加热反应制得的SO2分子数为2NA
C. 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
D. 2.4 g Mg与足量稀HCl完全反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将pH=8的NaOH溶液稀释1000倍,稀释后溶液中c(Na+)与c(OH-)之比接近
A. 1:1 B. 1:102 C. 102:1 D. 1:103
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
①钴不是主族元素;②![]() Cl2不能长期稳定地存在;③Mg的原子结构示意图为
Cl2不能长期稳定地存在;③Mg的原子结构示意图为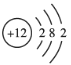 ;④鸟粪石中两种阳离子为Mg2+、NH4+
;④鸟粪石中两种阳离子为Mg2+、NH4+
A.①②③④B.仅①②④C.仅②③④D.仅①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+
Ca2+(aq)+
2OH-(aq),下列叙述正确的是( )
A. 给溶液加热,溶液的pH升高
B. 恒温下向溶液中加入CaO,溶液的pH升高
C. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
D. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物m、n、P存在如下转化关系。下列说法正确的是

A. m、n不存在同分异构体,p存在多种同分异构体
B. m、n、p均能使酸性高锰酸钾溶液褪色
C. m、n、p中所有原子可能共面
D. 等质量的m、n、p,完全燃烧耗氧量不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图![]() ,具有强还原性的弱酸,可以被银离子氧化为磷酸。
,具有强还原性的弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式____________;
(2)Na2HPO3是________(填“正盐”或“酸式盐”);
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的一级电离平衡常数Ka1=___________________;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”);
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3-、HPO32-的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
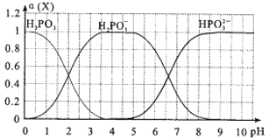
以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫黄在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,溴水褪色,乙变成丙。在丙里加入Na2S生成气体丁,把丁通入乙得到沉淀戊。甲、乙、丙、丁、戊均含有硫元素,则它们正确的顺序是
A. SO3、H2SO4、H2SO3、H2S、SB. SO2、H2SO3、H2SO4、SO2、SO3
C. SO3 、H2SO4、H2SO3、SO2、Na2S2O3D. SO2、H2SO3、H2SO4、H2S、S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com