
【题目】有机物m、n、P存在如下转化关系。下列说法正确的是

A. m、n不存在同分异构体,p存在多种同分异构体
B. m、n、p均能使酸性高锰酸钾溶液褪色
C. m、n、p中所有原子可能共面
D. 等质量的m、n、p,完全燃烧耗氧量不相等
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铅蓄电池放电时负极质量减轻,充电时阳极质量增加
B. 同温下,0.1 mol·L-1醋酸溶液pH=a,0.01 mol·L-1醋酸溶液pH=b,则a+1<b
C. 钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行防护
D. 一定条件下反应N2+3H2![]() 2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W、X、Y、Z的分子式均为C7H8,Z的空间结构类似于篮子。下列说法正确的是
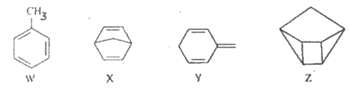
A. Z的一氯代物只有3种
B. 化合物W的同分异构体只有X、Y、Z
C. X、Y、Z均可与酸性KMnO4溶液反应
D. 1molX、1molY与足量Br2/CCl4溶液反应最多消耗Br2均为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反应(填“氧化”或“还原”)。
(2)现有一瓶放置了一段时间的某浓度的FeCl3溶液,请设计实验检验其中是否含有Fe3+_____。
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8LH2(已换算到标况下),则转移电子数目为_______;“引火铁” 是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
II.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
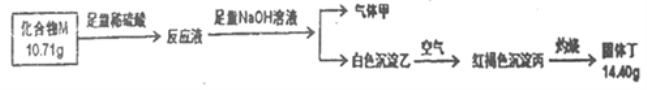
气体甲可使湿润红色石蕊试纸交蓝。请回答:
(1)M的化学式___________,气体甲的电子式__________。
(2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)_______________。(3)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
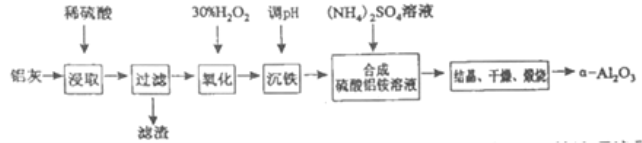
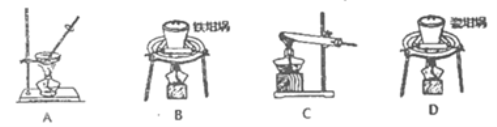
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号).
(2)流程中加入H2O2有气体产生,原因是___________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.己知:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
为保证产品的纯度,可以选用下列物质中的____调节溶液pH(填字母),调节pH的范围为_____。
a.A12O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
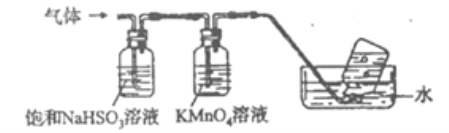
①集气瓶中收集到的气体是______(填化学式).
②装有KMnO4溶液洗气瓶的作用是________。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________,写出硫酸铝铵加入足量该试剂的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是镧系金属元素。空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3ˉ,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是
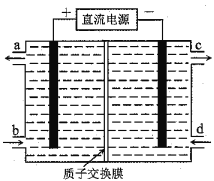
A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6eˉ=N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化HNO22mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
(1)滤液A的主要成分除NaOH外,还有_____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式_____________。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序______。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HC1 e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式______________。
②若用浓HNO3溶解金属硫化物,缺点是____________(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH﹣+H2↑
B. 用小苏打治疗胃酸过多:![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
C. 氯化铝溶液中加入过量氨水:Al3++3OH﹣=Al(OH)3↓
D. 三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100mL1.00mol/L的NaCl溶液时,下列说法正确的是( )
A.选用250mL容量瓶
B.俯视容量瓶刻度线定容
C.溶解搅拌时有液体溅出,会使所配制溶液浓度偏低
D.定容后摇匀,发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com