
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行最快的是( )
2SO3的化学反应速率,其中表示该反应进行最快的是( )
A. v(SO2)=4 mol·L-1·min-1B. v (O2)=3 mol·L-1·min-1
C. v (SO3)="0.1" mol·L-1·s-1D. v (O2)=0.1mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析化学、医药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol·L-1的NH4Al(SO4)2溶液中c((NH4+)________(填“等于”、“大于”或“小于”)0.1mol·L-1 NH4HSO4中c((NH4+).
(3)均为0.1mol·L-1的几种电解质溶液的pH随温度变化的曲线如图1所示.

①其中符合0.1mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是__,导致pH随温度变化的原因是___________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______.
(4)室温时,向100mL0.1mol·L-1的NH4HSO4溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH与所加NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向盐酸中加入氨水至中性,溶液中![]()
B. 在蒸馏水中滴加浓H2SO4,Kw不变
C. 向0.1 mol/L CH3COOH溶液中加入少量水,溶液中![]() 增大
增大
D. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)= CH3OH(g),在体积为1L的恒容密闭容器中,充入2 molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始至达到平衡,用氢气表示的平均反应速率υ(H2)=_______mol/(L·min)
②下列说法正确的是______(填字母序号)。
A.达到平衡时,CO的转化率为75%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
③该条件下反应的平衡常数K=______。
(2)已知:I.CO的燃烧热为△H=-283.0kJ·mol-1
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1
III.2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
则①2CH3OH(g)+CO(g)+![]() O2(g)
O2(g)![]() CH3OCOOCH3(g)+ H2O( l) △H=_____。
CH3OCOOCH3(g)+ H2O( l) △H=_____。
②对于可逆反应2CH3OH(g)+CO(g)+ ![]() O2(g)
O2(g)![]() CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH![]() 3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
(4)若往20mL0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______(填序号)。

①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂、反应条件和产物已略去):

已知:I、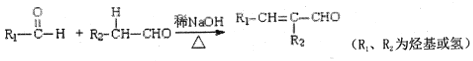
II、
(1)A分子的名称为______,B分子中所含官能团的名称为_______,由C到D的反应类型为_______;
(2)乙炔和羧酸X发生加成反应生成E,E的核磁共振氢谱有三组峰,且峰面积比为3:2:1,E能发生水解反应,则E的结构简式为_______;
(3)D和G反应生成光刻胶的化学方程式为______;
(4)C的同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②分子中只有一个环状结构。满足上述条件的同分异构体有______种。其中苯环上的一氯取代产物只有两种的同分异构体的结构简式为:_______
(5)根据已有知识并结合本题信息,写出以 CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是

A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减小
B. HA的电离常数KHA=10-7x/(100-x)(x为滴定分数)
C. 当滴定分数为100时,溶液中水的电离程度最大
D. 滴定分数大于100时,溶液中离子浓度关系是c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(以下各空用适当的化学用语或关系式填写)密闭容器中mA(g)+nB(g)pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图所示.则:

(1)增大压强:A的转化率______,平衡向______ 移动,达到平衡后,混合物中C的质量分数______.
(2)上述化学方程式中的系数m、n、p的正确关系是______.
(3)当降低温度时,C的质量分数增大,则:平衡向______移动,A的转化率______,正反应是______ 热反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已达化学平衡的下列反应 2X(g)+Y(s)![]() 2Z(g)增大压强时,对反应产生的影响是
2Z(g)增大压强时,对反应产生的影响是
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正、逆反应速率都增大,平衡不发生移动
D. 正、逆反应速率都增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(J)。合成化合物I的路线如下:

已知:①
②RCHO+HOOCCH2COOH![]() RCH=CHCOOH
RCH=CHCOOH
③当羟基与双键碳原子相连时,易发生转化:RCH-CHOH=RCHCHO
请回答下列问题:
(l)化合物F的名称是____;B-C的反应类型是____。
(2)化合物E中含氧官能团的名称是____;G-H的反应所需试剂和条件分别是____、____。
(3)写出化合物C与新制Cu(OH)2悬浊液反应的化学方程式____。
(4)化合物W与E互为同分异构体,两者所含官能团种类和数目完全相同,且苯环上有3个取代基,则W可能的结构有____种(不考虑顺反异构),其中核磁共振氢谱显示有6种不同化学环境的氢,峰面积比为2:2:1:1:1:1,写出符合要求的W的结构简式____。
(5)参照上述合成路线,设计由CH3CH=CH2和HOOCCH2COOH为原料制备 CH3CH2CH=CHCOOH的合成路线(无机试剂任选)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com