
【题目】下列有关电解质溶液的说法正确的是( )
A. 向盐酸中加入氨水至中性,溶液中![]()
B. 在蒸馏水中滴加浓H2SO4,Kw不变
C. 向0.1 mol/L CH3COOH溶液中加入少量水,溶液中![]() 增大
增大
D. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
【答案】C
【解析】
A. 向盐酸中加入氨水至中性,溶液中电荷守恒为c(NH4+)+c(H+) = c(OH-)+c(Cl-)得到c(NH4+) = c(Cl-);
B. 溶液中离子积常数随温度变化;
C. 向0.1 mol/L CH3COOH溶液中加入少量水促进醋酸电离,氢离子物质的量增大,醋酸物质的量减少;
D. 醋酸钠溶液中醋酸根离子水解溶液显碱性,水解过程吸热,升温平衡正向进行,水解平衡常数增大。
A. 向盐酸中加入氨水至中性,溶液中电荷守恒为c(NH4+)+c(H+) = c(OH-)+c(Cl-),得到c(NH4+) = c(Cl-),则![]() = 1,故A项错误;
= 1,故A项错误;
B. 溶液中离子积常数随温度变化,在蒸馏水中滴加浓H2SO4,浓硫酸溶解放热,溶液温度升高,促进水的电离,Kw增大,故B项错误;
C. 向0.1mol/L CH3COOH溶液中加入少量水促进醋酸电离,氢离子物质的量增大,醋酸物质的量减少,溶液中![]() 增大,故C项正确;
增大,故C项正确;
D. 醋酸钠溶液中醋酸根离子水解溶液显碱性,水解过程吸热,升温平衡向正向进行,水解平衡常数Kh增大,Kh = ![]() 增大,则
增大,则![]() 减小,故D项错误;
减小,故D项错误;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)的能量变化如图所示,有关叙述中不正确的是( )
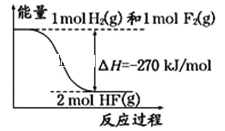
A. 氟化氢气体分解生成氢气和氟气的反应是吸热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D. 断裂1 mol H﹣H键和1 mol F﹣F 键吸收的能量小于形成2 mol H﹣F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应 2NO2(g)![]() N2O4(g) ΔH<0, 增大压强,下列说法正确的是( )
N2O4(g) ΔH<0, 增大压强,下列说法正确的是( )
A. 平衡逆向移动 B. 混合气体颜色比原来深
C. 混合气体颜色比原来浅 D. 混合气体的平均相对分子质量变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z和Q在周期表中的位置如图所示,其中元素Q位于第四周期,X、Y、Z原子的最外层电子数之和为17。下列说法正确的是

A. 简单离子半径(r):r(Q)>r(Y)>r(Z)
B. 氧化物对应的水化物的酸性:Z>Y
C. XY2和XZ4均含有非极性共价键
D. 标准状况下Z的单质状态与Q的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是____________________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应![]()
副反应:![]()
某化学小组利用上述原理在实验室制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。

(2)装置中盛放双氧水的仪器名称是_________。
(3)装置a中反应产生的气体需要持续通入装置c的原因是______________________。
(4)上述装置中还需补充的实验仪器或装置有__________(填字母)。
A.温度计 B.洗气瓶 C.水浴加热装置 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L。
②![]() ,
,![]() ,AgI呈黄色,
,AgI呈黄色,![]() 优先与
优先与![]() 反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用
反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用![]() mol/L的标准
mol/L的标准![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液的体积为5.00mL。
溶液的体积为5.00mL。
(5)滴定终点的现象是__________________________________。
(6)处理后的废水中氰化钠的浓度为_________mg/L;处理后的废水是否达到排放标准?___________(填“是”或“否”)。
Ⅲ.(7)常温下,含硫微粒主要存在形式,受pH影响。利用电化学原理,用惰性电极电解饱和![]() 溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为
溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为![]() ,则阳极反应方程式为_____________________。
,则阳极反应方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①KCl晶体 ②液态HCl ③CO2 ④汞 ⑤CaCO3固体 ⑥稀硫酸 ⑦酒精C2H5OH ⑧熔融的NaCl ⑨浓氨水
其中属于混合物的是(填序号,下同)___;属于电解质的是___;属于非电解质的是___;能导电的有____。
(2)某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
①将1mol·L-1的FeCl3 溶液逐滴滴入沸水中,液体变为__色,得到的是Fe(OH)3胶体;反应的化学方程式为____。
②怎样证明制得的物质是胶体?请简述操作过程:____。
③取少量制得的胶体加入试管中,再加入少量NaCl溶液,观察到的现象是__,这种现象称为胶体的____。
④Fe(OH)3胶体能稳定存在的主要原因是___(填序号)。
A.胶粒直径小于1nm B.胶粒带正电荷
C.胶体离子作无规则运动(即布朗运动) D.胶粒能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )

A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C. b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D. V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行最快的是( )
2SO3的化学反应速率,其中表示该反应进行最快的是( )
A. v(SO2)=4 mol·L-1·min-1B. v (O2)=3 mol·L-1·min-1
C. v (SO3)="0.1" mol·L-1·s-1D. v (O2)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种强氧化剂,可用于检测酒驾中酒精的含量,电化学制备K2Cr2O7的装置如图所示,其中a、b均为石墨电极。下列说法正确的是

A. X是电源的正极
B. 电解过程中K+向b极移动
C. b极上发生的电极反应为:2CrO42-+2H+=Cr2O72-+H2O
D. 理论上a、b两电极放出的气体的物质的量之比为2︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com